
铁是人体必需的微量元素之一,缺铁性贫血(irondeficiency anemia,IDA)是由于体内缺少铁,影响血红蛋白合成而引起的一种贫血。IDA是我国普遍存在的营养缺乏性贫血,影响人口广泛,发病率高,严重影响国民健康及生活质量[1]。口服补铁剂是目前世界范围内治疗IDA较为有效的途径之一。市售补铁剂种类繁多,分为无机铁和有机铁2 种作用形式[2]。以蛋白质水解所得多肽为螯合底物的复合微量元素补铁剂是针对我国IDA人群开发的一种新型功能性产品,其具有含铁量高、易消化吸收、生物利用率高等特点[3-5],相对于氨基酸补铁剂来说,其价格、生产工艺及成本更具优势。早在1960年,Newey等[6]通过实验证实小肽螯合铁可以直接被小肠吸收。多肽铁螯合物以肽链中的氨基、羰基、羧基和羟基与铁通过共价结合形成稳定的五元或六元环状结构[7]。现有研究大多从鱼皮[8-9]、鱼类副产物[10-11]、其他低值水产品[12-13]、豆类[14-16]、花生[17]和米渣[18]等可食性动植物中获得具有铁螯合活性的小肽。康雯蕾等[18]制备的大米肽在最优螯合条件下对氯化亚铁的螯合能力为21.6 mg/g,螯合物得率为65.2%。霍健聪等[11]发现,舟山带鱼下脚料水解多肽亚铁螯合物的最佳螯合条件为抗坏血酸0.1%、温度20 ℃、时间15 min、pH 7。此外,Lee等[19]利用风味蛋白酶从猪血浆蛋白水解物中获得了铁螯合活性壬肽Asp-Leu-Gly-Glu-Gln-Tyr-Phe-Lys-Gly。
猪血是生猪屠宰的副产品,是一种蛋白质含量高、糖类和脂肪含量低、微量元素含量丰富的食品工业原料[20]。猪血中蛋白质占4.3%,且为全价蛋白质[21]。同时,猪血铁含量为45 mg/100 g,还含有钙、镁、锌、铜、磷、钾、钠、锰、硒等微量元素[22]。猪血离心后,血浆液占65%,其中含有球蛋白和白蛋白等;血球液占35%,其中大部分是血红蛋白[23-24]。我国是全球猪肉消费量最大的国家,2017年猪肉消费总量达5 487 万t。我国也是全球生猪出栏量最大的国家,2017年生猪出栏量6.89 亿头[25]。因此,我国猪血资源利用产业的发展前景广阔。
本研究以猪血为原料,利用碱性蛋白酶制备猪血多肽,以猪血自身离子化铁和外源铁元素作为铁源,通过单因素试验对猪血复合微量元素补铁剂螯合工艺中的pH值、反应温度、反应时间、多肽溶液质量分数、多肽溶液与FeCl2溶液体积比进行研究,在此基础上采用响应面法优化,以期制备出吸收率高、安全、无消化道刺激、没有副作用的多肽亚铁螯合物复合微量元素补铁剂,为猪血蛋白资源的开发利用提供参考。
猪血,购自合肥万润食品有限公司。
盐酸、硝酸、高氯酸、硫酸、氢氧化钠、氯化亚铁、硫酸铁铵、柠檬酸钠、抗坏血酸、乙醇、碱性蛋白酶 合肥博美生物科技有限公司;所有溶剂均为国产分析纯。
FD-1CE冷冻干燥机 北京德天佑科技发展有限公司;1~10 mm石英微量比色皿 江苏省无锡市晶禾光学仪器有限公司;1900PC双光束紫外-可见分光光度计 上海谱元仪器有限公司;KT260全自动凯氏定氮仪 丹麦福斯分析仪器公司;HR801酶标分析仪 深圳市华科瑞科技有限公司;iCE 3500原子吸收光谱仪 美国赛默飞世尔公司;L-8900氨基酸自动分析仪 日本日立公司。
1.3.1 复合微量元素补铁剂制备工艺
复合微量元素补铁剂制备工艺:猪血→离心分离→喷雾干燥→酶解→螯合→复合微量元素补铁剂
操作要点:向猪血中加入0.4 mg/L的柠檬酸钠抗凝,于4 ℃、3 500 r/min条件下离心15 min,获得血浆液和血球液,分别喷雾干燥制得血浆粉和血球粉,然后分别进行酶解,中性蛋白酶添加量0.01 mg/L,底物质量浓度150 g/L,酶解温度45 ℃,酶解时间4 h;酶解结束后于90 ℃水浴灭酶6 min,分别制得血浆酶解液和血球酶解液,随后,将血球酶解液于3 000 r/min离心20 min,所得沉淀酸解成离子态;最后,将所得酸解液、离心上清液与血浆酶解液混合,于35 ℃、pH 6条件下螯合反应5 h,干燥成粉,即得复合微量元素补铁剂。
1.3.2 理化与营养检测
水分含量:参照GB/T 5009.3—2016《食品安全国家标准 食品中水分的测定》[26]中的直接干燥法;蛋白质含量:参照GB/T 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》[27]中的凯氏定氮法;脂肪含量:参照GB/T 5009.6—2016《食品安全国家标准 食品中脂肪的测定》[28]中的索氏抽提法;铁含量:参照GB/T 5009.90—2016《食品安全国家标准 食品中铁的测定》[29]中的火焰原子吸收光谱法;氨基酸组成分析:参照GB/T 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》[30]。
1.3.3 铁的离子化
猪血自身含有丰富的铁元素,在螯合前需将铁离子化,以便根据不同需求进行添加。血浆蛋白和血球蛋白分别酶解离心,所得沉淀冷冻干燥,用稀盐酸溶解,调节pH值至4~5,加入3%抗坏血酸标准溶液,制得沉淀酸解液备用。同时,酸化外源铁溶液(1.0 mol/L FeCl2溶液中加入3%抗坏血酸标准溶液)作为螯合反应的铁源。
1.3.4 猪血多肽溶液制备
称取一定量的血浆蛋白粉和血球蛋白粉,分别进行酶解,离心取上清液,加入质量分数为2%的活性炭,温度57 ℃、pH 4.3条件下脱色60 min;然后,采用中空纤维超滤设备,选取截留分子质量为10 kD的纤维柱进行分离及脱色,以除去大分子蛋白类物质,在旋转蒸发器上浓缩至原体积的1/10,最后进行冷冻干燥,制得多肽粉成品。使用时,用去离子水溶解多肽粉,配制成不同质量分数的多肽溶液。
1.3.5 Fe2+螯合率测定
以谷胱甘肽(glutathione,GSH)(20 mg/mL)和乙二胺四乙酸(elhylene diamine tetraacetic acid,EDTA)(5 mg/mL)作为阳性对照组,含有FeCl2和猪血多肽的溶液作为空白组。铁含量采用火焰原子吸收光谱法测定[29]。Fe2+螯合率按照下式计算。

式中:c样品、c空白和c总分别为肽-Fe2+、猪血多肽、FeCl2和猪血多肽混合溶液的铁含量。
1.3.6 单因素试验设计
选择pH值、反应温度、反应时间、多肽溶液质量分数、多肽溶液与FeCl2溶液(1.0 mol/L)体积比5 个因素作为主要单因素,考察各因素对多肽Fe2+螯合率的影响。
多肽溶液质量分数为2%、多肽溶液与FeCl2溶液的体积比为2∶1时,加入固定体积的沉淀酸解液,温度30 ℃,分别在pH值3、4、5、6、7条件下反应1 h,测定不同pH值条件下的Fe2+螯合率。
多肽溶液质量分数为2%、多肽溶液与FeCl2溶液的体积比为2∶1时,加入固定体积的沉淀酸解液,pH值为6,反应时间1 h,测定在25、35、45、55、65 ℃反应温度下的Fe2+螯合率。
多肽溶液质量分数为2%、多肽溶液与FeCl2溶液的体积比为2∶1时,加入固定体积的沉淀酸解液,pH值为6,反应温度30 ℃,测定反应时间为15、25、35、45、55 min条件下的Fe2+螯合率。
配制质量分数分别为1%、2%、3%、4%、5%的多肽溶液,多肽溶液与FeCl2溶液的体积比为2∶1,加入固定体积的沉淀酸解液,pH值为6,反应时间1 h,反应温度30℃,测定不同质量分数多肽溶液的Fe2+螯合率。
多肽溶液质量分数为2%,多肽溶液与FeCl2溶液的体积比分别选择1∶1、2∶1、3∶1、4∶1、5∶1,加入固定体积的沉淀酸解液,反应温度30 ℃,pH值为6,反应时间1 h,测定不同多肽溶液1.0 mol/L与FeCl2溶液体积比时的Fe2+螯合率。
1.3.7 响应面试验因素及水平
根据Box-Behnken试验设计方案,综合单因素试验结果,选择单因素试验中的显著因素(pH值、多肽溶液质量分数和多肽溶液与1.0 mol/L FeCl2溶液体积比)进行优化,因素水平设计如表1所示。
表 1 响应面试验因素水平表
Table 1 Coded levels and corresponding actual levels of independent variables used for Box-Behnken design
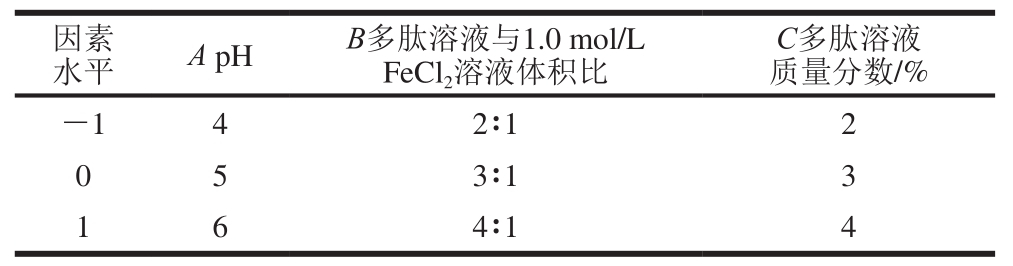
水平 A pH B多肽溶液与1.0 mol/L FeCl2溶液体积比因素C多肽溶液质量分数/%-1 4 2∶1 2 0 5 3∶1 3 1 6 4∶1 4
每个处理组进行3 次独立实验,结果以平均值±标准差表示。利用Design-Expert 8.0.5软件,通过单因素方差分析和Duncan's多重比较分析数据显著性并作图。
表 2 猪血粉和复合微量元素补铁剂的理化及营养指标
Table 2 Chemical and nutritional compositions of pig blood powder and composite microelement iron supplement
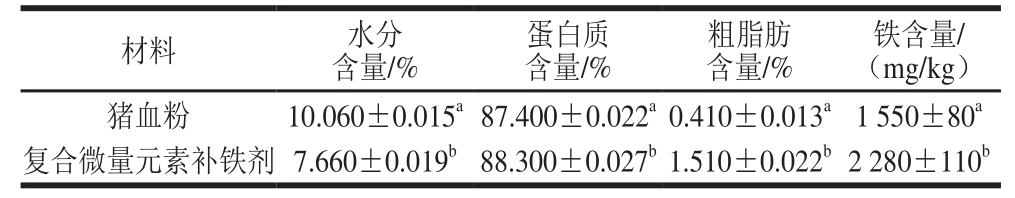
注:同列小写字母不同,表示差异显著(P<0.05)。
铁含量/(mg/kg)猪血粉 10.060±0.015a87.400±0.022a0.410±0.013a1 550±80a复合微量元素补铁剂 7.660±0.019b88.300±0.027b1.510±0.022b2 280±110b材料 水分含量/%蛋白质含量/%粗脂肪含量/%
由表2可知:猪血粉的水分含量相对较高,为10.060%,粗脂肪含量相对较低,仅0.410%;制备成复合微量元素补铁剂后水分含量下降至7.660%,粗脂肪含量上升为1.510%。此外,复合微量元素补铁剂的铁含量达到2 280 mg/kg,相比猪血粉显著提高(P<0.05)。
表 3 猪血粉和复合微量元素补铁剂的氨基酸组成
Table 3 Amino acid compositions of pig blood powder and composite microelement iron supplement%

注:*. 必需氨基酸;—.未检出。同行小写字母不同,表示差异显著(P<0.05)。
氨基酸种类 猪血粉 复合微量元素补铁剂天冬氨酸(Asp) 12.310±0.023a 11.350±0.017b苏氨酸(Thr)* 3.720±0.017a 4.680±0.025b丝氨酸(Ser) 5.110±0.025a 5.540±0.009b谷氨酰胺(Glu) 10.200±0.023a 12.590±0.034b甘氨酸(Gly) 4.010±0.008a 3.910±0.018b丙氨酸(Ala) 7.900±0.005a 6.920±0.021b半胱氨酸(Cys) 1.170±0.002a 2.290±0.016b缬氨酸(Val)* 8.120±0.016a 7.470±0.008b蛋氨酸(Met)* 0.890±0.003a 1.020±0.002b异亮氨酸(Ile)* 0.720±0.002a 1.810±0.004b亮氨酸(Leu)* 13.740±0.022a 11.900±0.012b酪氨酸(Tyr) 2.720±0.016a 3.600±0.003b苯丙氨酸(Phe)* 7.110±0.016a 6.460±0.013b赖氨酸(Lys)* 9.060±0.025a 8.650±0.004b组氨酸(His) 7.380±0.011a 5.550±0.007b色氨酸(Trp)* — —精氨酸(Arg) 4.470±0.005a 4.770±0.007b必需氨基酸总量 43.360±0.036a 41.990±0.033b
由表3可知:猪血粉和复合微量元素补铁剂中均检出16 种氨基酸(色氨酸在水解时被破坏,故未检出),其中必需氨基酸7 种,氨基酸含量较为丰富。猪血粉的必需氨基酸总量为43.360%,复合微量元素补铁剂的必需氨基酸总量略低,为41.990%,其中亮氨酸含量最高,为11.900%,赖氨酸次之,为8.650%。
2.3.1 pH值对Fe2+螯合率的影响
由图1可知:pH值由3升高至5时,Fe2+螯合率随着pH值的升高而增加(P<0.05),在pH值为5时达到最大;当pH值继续升高时,Fe2+螯合率又显著减小(P<0.05)。这可能是由于当pH值大于5时,酸碱度影响了猪血多肽螯合底物的空间构象[31]和铁元素的形态,从而影响了铁离子与底物的结合,故反应时pH值应控制在5左右。

图1 pH值对Fe2+螯合率的影响
Fig. 1 Effect of pH value on Fe2+ chelating rate
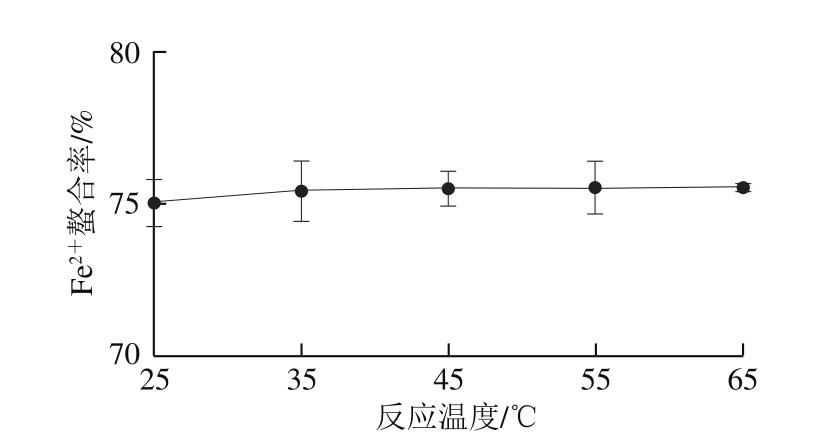
图2 反应温度对Fe2+螯合率的影响
Fig. 2 Effect of reaction temperature on Fe2+ chelating rate
2.3.2 反应温度对Fe2+螯合率的影响由图2可知,反应温度在25~65 ℃范围内变化时,Fe2+螯合率没有显著变化(P>0.05),因此,反应温度控制在25 ℃左右即可。
2.3.3 反应时间对Fe2+螯合率的影响
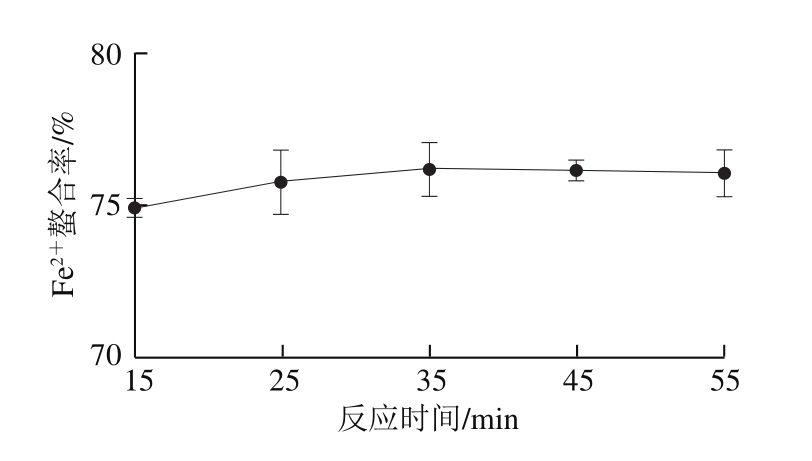
图3 反应时间对Fe2+螯合率的影响
Fig. 3 Effect of reaction time on Fe2+ chelating rate
由图3可知,反应时间在15~55 min范围内变化时,Fe2+螯合率没有显著变化(P>0.05)。因此,为提高实验和生产效率,反应时间在15 min左右即可。
2.3.4 多肽溶液质量分数对Fe2+螯合率的影响
由图4可知:多肽溶液质量分数从1%上升至3%时,Fe2+螯合率随着多肽溶液质量分数的升高而增加(P<0.05),在多肽溶液质量分数为3%时达到最大;当多肽溶液质量分数继续升高时,Fe2+螯合率又显著降低(P<0.05)。故反应时多肽溶液质量分数应控制在3%左右。
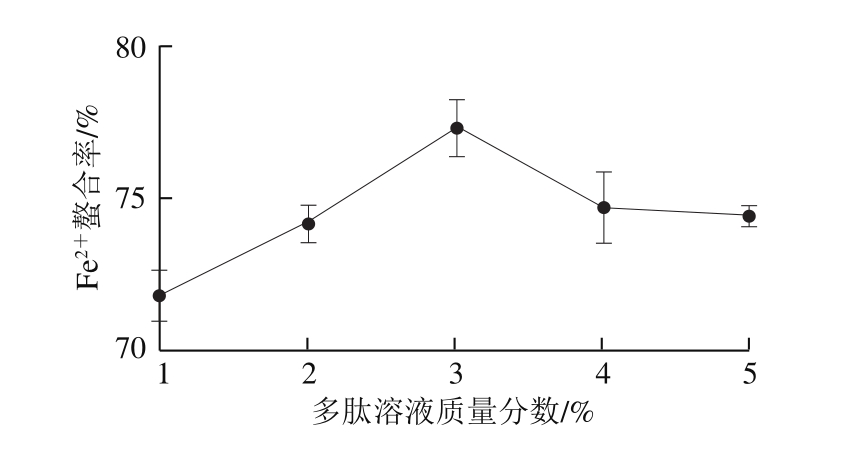
图4 多肽溶液质量分数对Fe2+螯合率的影响
Fig. 4 Effect of peptide concentration on Fe2+ chelating rate
2.3.5 多肽溶液与1.0 mol/L FeCl2溶液体积比对Fe2+螯合率的影响

图5 多肽溶液与1.0 mol/L FeCl2溶液体积比对Fe2+螯合率的影响
Fig. 5 Effect of volume ratio of peptide solution to FeCl2 solution(1.0 mol/L) on Fe2+ chelating rate
由图5可知:当多肽溶液与1.0 mol/L FeCl2溶液的体积比低于3∶1时,Fe2+螯合率随着体积比的升高而增加(P<0.05),在体积比为3∶1时达到最大值;当体积比持续升高至5∶1时,Fe2+螯合率反而下降(P<0.05)。故反应时多肽溶液与1.0 mol/L FeCl2溶液的体积比应控制在3∶1左右。
通过以上5 个条件的猪血多肽Fe2+螯合率单因素试验可以发现,pH值、多肽溶液质量分数、多肽溶液与FeCl2溶液体积比3 个因素的变化对Fe2+螯合率具有显著影响(P<0.05),而反应温度和反应时间对于多肽的Fe2+螯合率影响不显著(P<0.05)。霍健聪等[11]对带鱼下脚料蛋白多肽亚铁螯合物的研究结果也证明pH值的影响显著。在后续的响应面试验中,仅针对pH值、多肽溶液质量分数、多肽溶液与1.0 mol/L FeCl2溶液体积比3 个因素进行螯合工艺的优化。根据单因素试验结果,固定反应温度为25 ℃、反应时间为15 min。
2.4.1 响应面优化试验结果及其方差分析
根据Design-Expert 8.0.5软件设计3因素3水平的响应面试验,结果如表4所示。
表 4 复合微量元素补铁剂螯合工艺的响应面分析结果
Table 4 Box-Behnken design with experimental results
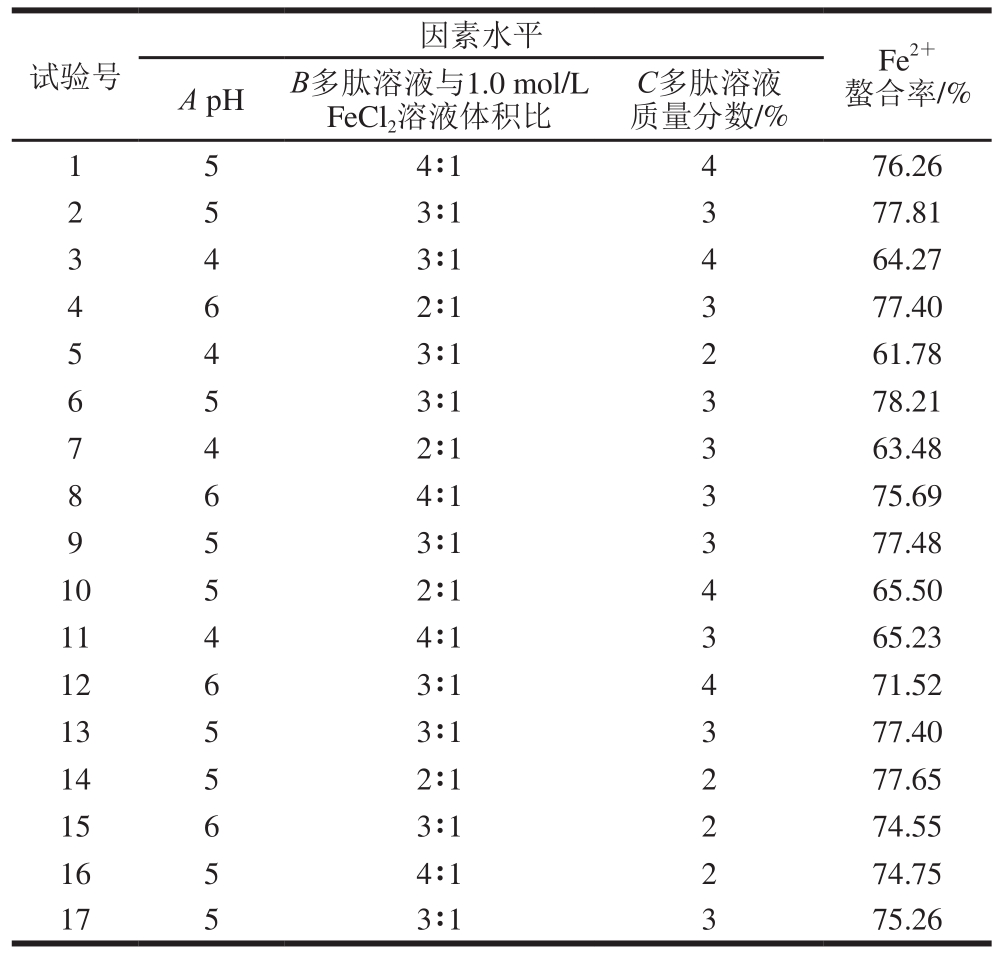
因素水平 Fe2+螯合率/%试验号A pH B多肽溶液与1.0 mol/L FeCl2溶液体积比C多肽溶液质量分数/%1 5 4∶1 4 76.26 2 5 3∶1 3 77.81 3 4 3∶1 4 64.27 4 6 2∶1 3 77.40 5 4 3∶1 2 61.78 6 5 3∶1 3 78.21 7 4 2∶1 3 63.48 8 6 4∶1 3 75.69 9 5 3∶1 3 77.48 10 5 2∶1 4 65.50 11 4 4∶1 3 65.23 12 6 3∶1 4 71.52 13 5 3∶1 3 77.40 14 5 2∶1 2 77.65 15 6 3∶1 2 74.55 16 5 4∶1 2 74.75 17 5 3∶1 3 75.26
采用软件程序对以上的实验数据进行二次多元回归拟合,分析结果得出多肽Fe2+螯合率的回归方程为:Y=-139.106 0+73.745 0A-1.116 5B+13.593 5C-0.865 0AB-1.380 0AC+3.415 0BC-6.146 0A2-0.636 0B2-3.056 0C2。
表 5 响应面回归模型的方差分析
Table 5 Analysis of variance of response surface regression model
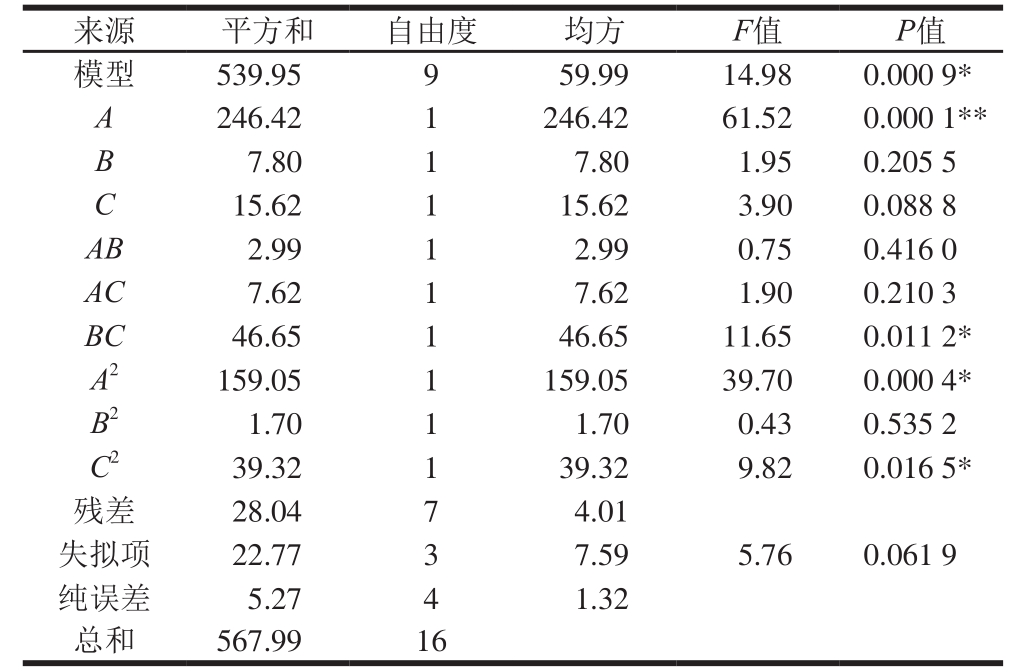
注: **. 差异极显著;*. 差异显著。
来源 平方和 自由度 均方 F值 P值模型 539.95 9 59.99 14.98 0.000 9*A 246.42 1 246.42 61.52 0.000 1**B 7.80 1 7.80 1.95 0.205 5 C 15.62 1 15.62 3.90 0.088 8 AB 2.99 1 2.99 0.75 0.416 0 AC 7.62 1 7.62 1.90 0.210 3 BC 46.65 1 46.65 11.65 0.011 2*A2 159.05 1 159.05 39.70 0.000 4*B2 1.70 1 1.70 0.43 0.535 2 C2 39.32 1 39.32 9.82 0.016 5*残差 28.04 7 4.01失拟项 22.77 3 7.59 5.76 0.061 9纯误差 5.27 4 1.32总和 567.99 16
为检验上述方程的有效性,对回归模型进行方差分析。由表5可知,模型显著(P<0.05),说明该模型能够解释大部分实验情况的变化,同时失拟项不显著,进一步说明了该模型的合理性。因此,可以用此模型对整个实验结果进行分析和预测。
3 个因素对补铁剂Fe2+螯合率的影响比较复杂。在上述回归方程的所有一次项中,对于多肽的Fe2+螯合率影响顺序为A>C>B,其中A项影响极显著(P<0.000 1),即pH值对螯合率的影响较大;在所有的平方项中,A2和C2项影响显著(P<0.05);而交互项中仅BC交互项的影响显著(P<0.05)。因此,各因素对补铁剂Fe2+螯合率的影响顺序为pH值>多肽溶液质量分数>多肽溶液与1.0 mol/L FeCl2溶液体积比。
2.4.2 响应面优化试验的两因素交互作用分析
采用Design-Expert 8.0.5软件,带入实验数据,分别将模型中的pH值(A)、多肽溶液与1.0 mol/L FeCl2溶液体积比(B)及多肽溶液质量分数(C)的其中1 个因素固定在0水平不变,得到其余2 个因素之间的相互作用对Fe2+螯合率的影响。通过软件的Model Graphs分别合成因素间交互作用影响的三维图和等高线图。
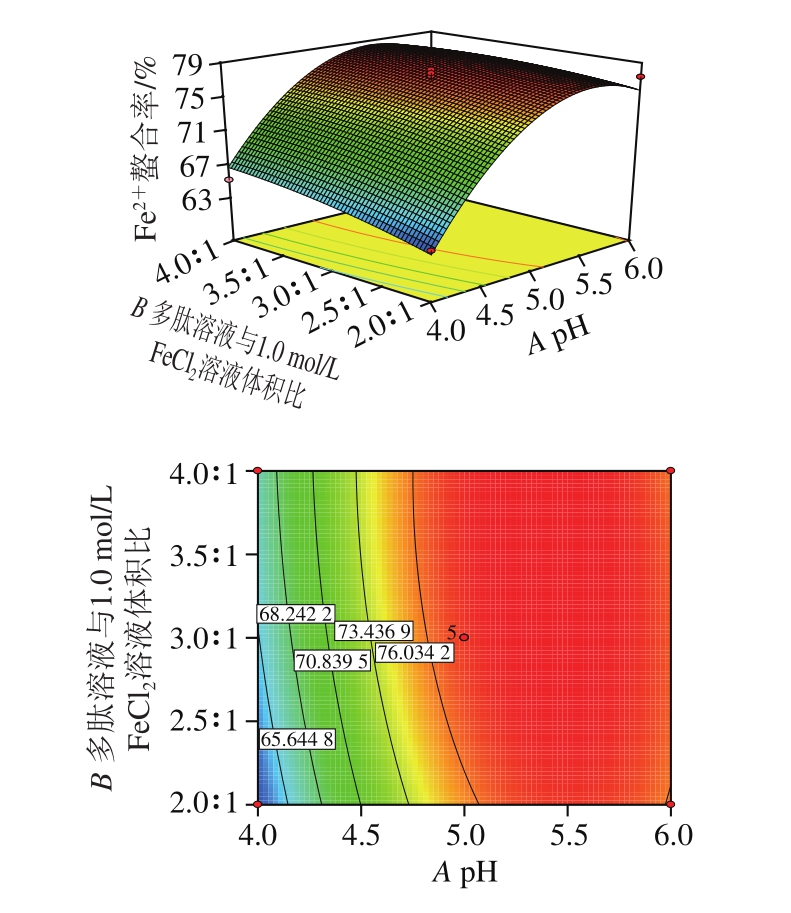
图6 pH值和多肽溶液与1.0 mol/L FeCl2溶液体积比对Fe2+螯合率交互作用影响的三维图和等高线图
Fig. 6 Three-dimensional response surface and contour plots showing the effect of interaction between pH value and volume ratio of peptide solution to (1.0 mol/L) FeCl2 solution on Fe2+ chelating rate
由图6可知:当多肽溶液与1.0 mol/L FeCl2溶液体积比为3∶1,pH值在4.0~5.0范围内增加时,猪血多肽的Fe2+螯合率迅速上升,pH值在5.0~6.0范围内增加时,猪血多肽的Fe2+螯合率缓慢下降;pH值为5.0时,猪血多肽的Fe2+螯合率随着多肽溶液与1.0 mol/L FeCl2溶液体积比的增加而缓慢上升。
由图7可知:当多肽溶液质量分数为3%,pH值在4.0~5.0范围内增加时,猪血多肽的Fe2+螯合率迅速上升,pH值在5.0~6.0范围内增加时,猪血多肽的Fe2+螯合率缓慢下降;pH值为5.0时,猪血多肽的Fe2+螯合率随着多肽溶液质量分数的增加先上升后下降。
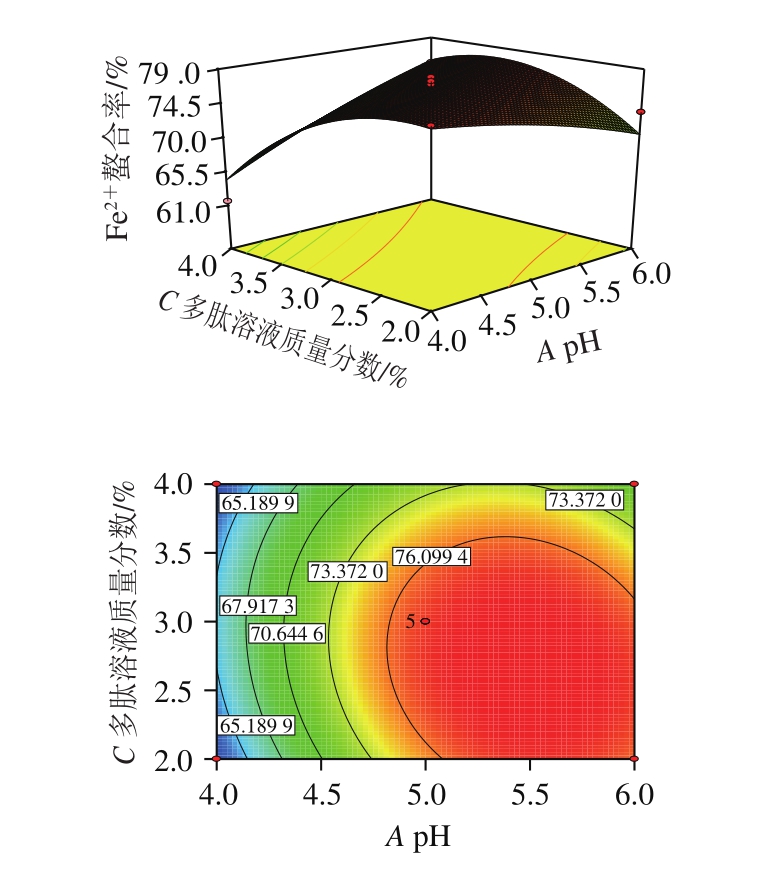
图7 pH值和多肽溶液质量分数对Fe2+螯合率交互作用影响的三维图和等高线图
Fig. 7 Three-dimensional response surface and contour plots showing the effect of interaction between pH value and peptide concentration on Fe2+ chelating rate
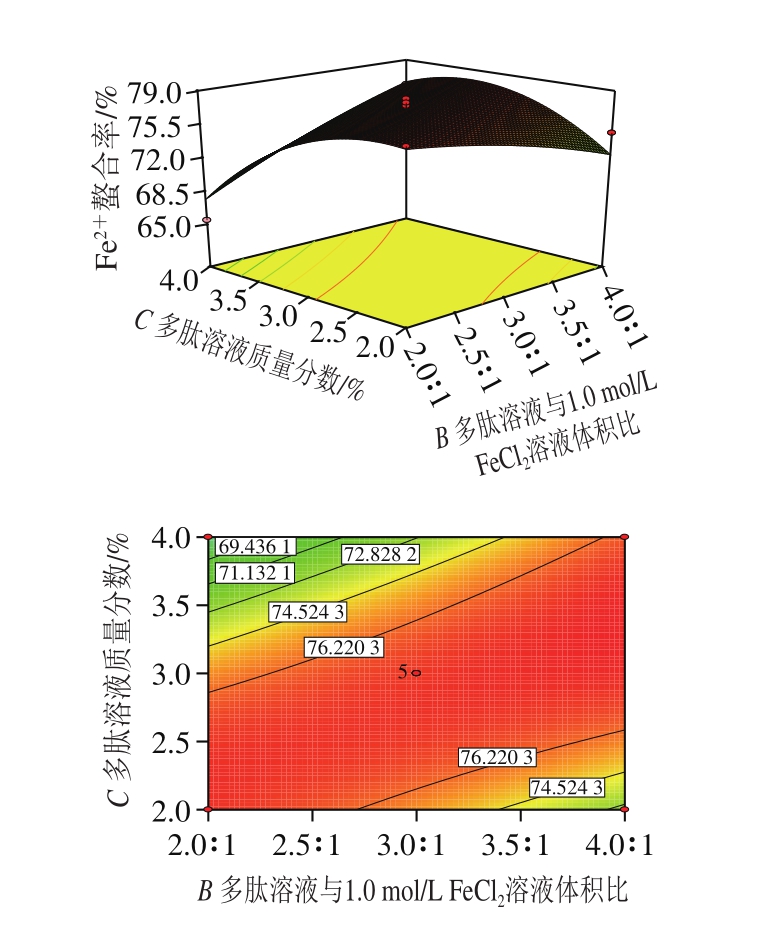
图8 多肽溶液与1.0 mol/L FeCl2溶液体积比和多肽溶液质量分数对Fe2+螯合率交互作用影响的三维图和等高线图
Fig. 8 Three-dimensional response surface and contour plots showing the effect of interaction between volume ratio of peptide solution to FeCl2 solution (1.0 mol/L) and peptide concentration on Fe2+ chelating rate
由图8可知:当多肽溶液质量分数为3%,多肽溶液与1.0 mol/L FeCl2溶液的体积比在2∶1~3∶1范围内增加时,猪血多肽的Fe2+螯合率缓慢上升,体积比在3∶1~4∶1范围内增加时,Fe2+螯合率基本不变;多肽溶液与1.0 mol/L FeCl2溶液的体积比为3∶1时,猪血多肽的Fe2+螯合率随着多肽溶液质量分数的增加先缓慢上升后下降。
根据Design-Expert 8.0.5软件程序对螯合工艺条件进行优化,得到最佳螯合工艺条件为pH值5.40、多肽溶液与1.0 mol/L FeCl2溶液体积比2.16∶1、多肽溶液质量分数2.27%。在此工艺条件下,补铁剂Fe2+螯合率的预测值为79.37%。
在上述最佳螯合工艺条件下进行3 次平行实验,结果取平均值,获得实测补铁剂Fe2+螯合率为79.41%,较预测值高0.04%。证明响应面分析法对于螯合工艺的优化结果准确可靠,有较高的实用价值。
猪血原料经过离心、酶解、酸解及螯合等工艺,可以得到铁含量丰富的复合微量元素补铁剂。在单因素试验中发现,pH值、多肽溶液质量分数、多肽溶液与1.0 mol/L FeCl2溶液体积比3 个因素对补铁剂的Fe2+螯合率具有显著影响,而反应温度和反应时间则影响不显著。选择反应温度25 ℃、反应时间15 min作为固定条件,通过响应面试验优化获得复合微量元素补铁剂的最佳螯合工艺条件为pH值5.40、多肽溶液质量分数2.27%、多肽溶液与1.0 mol/L FeCl2溶液体积比2.16∶1,在此条件下,补铁剂Fe2+螯合率的预测值为79.37%。本研究仅针对猪血加工制备复合微量元素补铁剂的工艺进行优化,仍需要进行产品效果的后续验证等研究。
[1] 寇艳婷, 王莹. 缺铁性贫血及其治疗的研究进展[J]. 中国现代医生,2017, 55(23): 165-168.
[2] 周艳蓉, 闵玉萍. 复方硫酸亚铁叶酸片在妊娠合并缺铁性贫血中的干预作用[J]. 医学综述, 2016, 8(22): 1606-1607.
[3] 霍健聪, 邓尚贵, 励建荣. 铁肽螯合物不同组分对缺铁性贫血大鼠贫血改善的研究[J]. 水产学报, 2014, 38(12): 2075-2083.
[4] 杨萍, 常青, 刘玉花. 酶法生产补血活性肽[J]. 食品研究与开发,2009(9): 27-28.
[5] 胡乔迁, 孙丰婷, 张萌, 等. 多肽-亚铁螯合物的研究进展[J]. 现代食品, 2018(13): 36-38. DOI:10.16736/j.cnki.cn41-1434/ts.2018.13.013.
[6] NEWEY H, SMITH D H. Intracellylar hydrolysis of dipeptides during intestinal absorption[J]. The Journal of Physiology, 1960, 152:367-380. DOI:10.1113/jphysiol.1960.sp006493.
[7] 王攀峰. 马鲛鱼加工副产物酶促水解制备铁结合肽的研究[D]. 杭州: 中国计量学院, 2014: 6.
[8] 段秀. 罗非鱼皮胶原蛋白肽亚铁螯合修饰及生物活性研究[D]. 昆明: 昆明理工大学, 2014: 17-19.
[9] GUO Lidong, HOU Hu, LI Bafang, et al. Preparation, isolation and identif i cation of iron-chelating peptides derived from Alaska pollock skin[J]. Process Biochemistry, 2013, 48(5/6): 988-993. DOI:10.1016/j.procbio.2013.04.013.
[10] LIN Huimin, DENG Shanggui, HUANG Saibo. Antioxidant activities of ferrous-chelating peptides isolated from fi ve low-value fi sh protein hydrolysates[J]. Journal of Food Biochemistry, 2014, 38: 627-633.DOI:10.1111/jfbc.12103.
[11] 霍健聪, 邓尚贵, 谢超. 带鱼下脚料蛋白多肽亚铁螯合物的制备及抗氧化活性研究[J]. 食品工业科技, 2009, 30(4): 267-270.
[12] 刘晶晶, 汤会芳, 郭芝琳, 等. 河蚬肉抗氧化肽的分离及活性研究[J]. 食品工业科技, 2016, 37(4): 169-172. DOI:10.13386/j.issn1002-0306.2016.04.025.
[13] 任张燕. 虾加工副产物酶促水解制备铁结合肽的研究[D]. 杭州: 中国计量学院, 2013: 4-6.
[14] CARRASCO-CASTILLA J, HERNÁNDEZ-ÁLVAREZ A J,JIMÉNEZ-MARTÍNEZ C, et al. Antioxidant and metal chelating activities of peptide fractions from phaseolin and bean protein hydrolysates[J]. Food Chemistry, 2012, 135: 1789-1795. DOI:10.1016/j.foodchem.2012.06.016.
[15] TORRES-FUENTES C, ALAIZ M, VIOQUE J. Iron-chelating activity of chickpea protein hydrolysate peptides[J]. Food Chemistry, 2012,134: 1585-1588. DOI:10.1016/j.foodchem.2012.03.112.
[16] 刘静波, 刘畅, 赵颂宁, 等. 不同分子质量的大豆肽螯合钙工艺优化[J]. 中国食品学报, 2018, 18(6): 146-152. DOI:10.16429/j.1009-7848.2018.06.019.
[17] 李玉珍, 肖怀秋, 赵谋明, 等. 冷榨花生粕蛋白多肽-亚铁螯合物制备工艺优化及结构分析[J]. 中国粮油学报, 2017, 32(4): 106-110.
[18] 廉雯蕾, 王韧, 王莉, 等. 酸法脱酰胺结合酶解制备米蛋白肽及其与亚铁螯合工艺研究[J]. 中国粮油学报, 2016, 31(7): 58-63.
[19] LEE S H, SONG K B. Purification of an iron-binding nona peptide from hydrolysates if porcine blood plasma protein[J]. Process Biochemistry, 2009, 44: 378-381. DOI:10.1016/j.procbio.2008.12.001.
[20] 赵静. 猪血红蛋白铁螯合肽的制备及性质研究[D]. 长春: 吉林大学,2016: 1.
[21] 车振明, 高平. 猪血的综合开发和利用[J]. 农牧产品开发, 2000(3): 29-30.
[22] 黄群, 马美湖, 杨抚林. 畜禽血的开发利用[J]. 肉类研究, 2003,17(3): 1-2.
[23] 李芙琴, 马黎明. 浅谈家畜血液资源的开发利用[J]. 养殖与饲料,2010(6): 73-75.
[24] 靳义超. 我国动物血液资源的开发利用研究进展[C]//中国畜牧兽医学会信息技术分会2011年学术研讨会. 北京: 中国畜牧兽医学会,2011: 3-7. DOI:10.13300/j.cnki.cn42-1648/s.2010.06.041.
[25] 南荟喆. 我国生猪保险专题调查报告[D]. 石家庄: 河北经贸大学,2018: 1.
[26] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准食品中水分的测定: GB 5009.3—2016[S]. 北京: 中国标准出版社,2016.
[27] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中蛋白质的测定:GB/T 5009.5—2016[S]. 北京: 中国标准出版社, 2016.
[28] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中脂肪的测定: GB/T 5009.6—2016[S].北京: 中国标准出版社, 2016.
[29] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中铁的测定: GB/T 5009.90—2016[S].北京: 中国标准出版社, 2016.
[30] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中氨基酸的测定:GB/T 5009.124—2016[S]. 北京: 中国标准出版社, 2016.
[31] 潘晓倩, 成晓瑜, 张顺亮, 等. 响应面法优化猪血红蛋白抗菌肽的制备工艺[J]. 肉类研究, 2013, 27(11): 1-5.
Optimization of Iron Chelating for Pig Blood Derived Composite Iron Supplement Containing Multiple Trace Elements by Response Surface Methodology