多环芳烃分子印迹柱-高效液相色谱荧光检测法快速测定烤肉中15 种多环芳烃
阳文武1,谭顺中1,郭 娅1,*,周 浓2
(1.重庆市万州食品药品检验所,重庆 404000;2.重庆三峡学院生物与食品工程学院,重庆 404000)
摘 要:建立一种高效液相色谱-荧光检测(high performance liquid chromatography-fluorescence detection,HPLC-FLD)法同时测定烤肉中15 种多环芳烃(polycyclic aromatic hydrocarbons,PAHs)的方法。样品经超声提取,多环芳烃分子印迹柱(molecular imprinting column of PAHs,MIP-PAHs)净化,通过HPLC分离,外标法定量。结果表明:15 种PAHs在质量浓度1~50 ng/mL范围内与色谱峰面积呈良好的线性关系,r>0.999 5;在5.0、10.0、25.0 μg/kg 3 个加标水平下,平均回收率为71.1%~98.8%,相对标准偏差为1.0%~5.8%;方法检出限(RS/N=3)为0.33~3.30 μg/kg,定量限(RS/N=10)为1.0~10.0 μg/kg。
关键词:多环芳烃;烤肉;高效液相色谱-荧光检测;多环芳烃分子印迹柱;外标法定量
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是由2 个或2 个以上苯环稠合而成的一类芳香族化合物,主要由有机物质(包括油、木材、垃圾废物和煤)的热解和不完全燃烧产生,在食品加工过程(如熏、烤、烘培、煎、炸等)中可能产生PAHs。PAHs具有“三致”(致癌、致畸和致突变)毒性,属于持久性有机污染物[1-3]。欧盟委员会835/2011号文件《Amending regulation(EC) No 1881/2006 as regards maximum levels for polycyclic aromatic hydrocarbons in foodstuffs》规定,熏、烧、烤肉制品中苯并(a)芘的限量为2 μg/kg(欧盟委员会No1881/2006号文件《Setting maximum levels for certain contaminants in foodstuffs》规定限量为5 μg/kg),且PAH4(䓛、苯并(a)蒽、苯并(b)荧蒽、苯并(a)芘)的总量不大于12 μg/kg(欧盟委员会No1881/2006号文件规定总量不大于30 μg/kg),而我国GB 2762—2017《食品安全国家标准 食品中污染物限量》中仅对PAHs中的苯并(a)芘规定了限量为5 μg/kg(GB 2762—2012《食品安全国家标准 食品中污染物限量》中也为5 μg/kg),暂未对其他PAHs规定限量值。鉴于烤肉在日常生活中的重要性,对烤肉中PAHs的含量水平进行监测对确保烤肉安全具有十分重要的意义。
目前,关于PAHs污染情况的文献报道集中在水[4-6]、大气[7-9]、土壤[10-12]及食用油[13-15]等方面,对烤肉中PAHs的污染状况却鲜有报道。检测PAHs的方法主要有高效液相色谱-荧光检测(high performance liquid chromatography-fluorescence detection,HPLC-FLD)法[16-18]、气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)法[19-21]、高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)法[22-24]等,大部分已有报道多采用索氏提取法[25-27]、超声波提取法[28-30]等。索氏提取法整个过程耗时长,有机溶剂用量大,不适合实验室大批量的检验工作,本研究用少量乙腈超声提取后,采用多环芳烃分子印迹柱(molecular imprinting column of PAHs,MIP-PAHs)净化,净化后的样品进行HPLC-FLD检测。
1 材料与方法
1.1 材料与试剂
烤鸭(15 批次)、烤鸡肉(2 批次)、烤肉(2 批次)、烤羊肉(2 批次)、烤牛肉(3 批次)样品购自重庆市东北片区(包括万州区、梁平区、忠县、开州区、云阳县、奉节县、巫山县、巫溪县及城口县)不同摊位。
乙腈、正己烷、二氯甲烷(均为色谱纯) 北京迪马科技有限公司;15 种PAHs混合标准溶液 北京曼哈格生物科技有限公司;苊、芴、芘、菲、蒽、萘、荧蒽、苯并(a)蒽、苯并(a)芘、二苯并(a,h)蒽、苯并(b)荧蒽、茚并(1,2,3-c,d)芘、苯并(k)荧蒽、苯并(g,h,i)苝、䓛标准溶液 美国ChemService公司;MIP-PAHs 德国CNW公司。
1.2 仪器与设备
Agilent 1260高效液相色谱仪(配备荧光检测器)美国安捷伦科技有限公司;KH-2000DB超声波清洗器昆山禾创超声仪器有限公司;摩尔基因型1850C超纯水机上海摩勒科学仪器有限公司;IKA MS3涡旋振荡器德国IKA公司;Waters固相萃取装置 美国Waters公司;Sartorius SQP分析天平 瑞士梅特勒-托利多公司;BiotageTurboVap2氮吹仪 瑞典Biotage公司;4-16S离心机 德国Sigma公司。
1.3 方法
1.3.1 标准溶液的配制
单标溶液配制:分别准确量取各种单标溶液适量,用乙腈稀释成质量浓度为10 ng/mL的单标溶液。
PAHs标准中间液配制:准确移取0.1 mL PAHs混合标准溶液(15 种PAHs的质量浓度均为200 μg/mL)于100 mL棕色容量瓶中,用乙腈定容,得质量浓度为200 ng/mL的标准中间液,4 ℃保存,有效期为3 个月。
PAHs标准工作液配制:分别准确移取0.05、0.25、0.50、1.00、2.50 mL PAHs标准中间液于10 mL棕色容量瓶中,用乙腈定容,配制成质量浓度分别为1、5、10、20、50 ng/mL的系列标准工作液。
1.3.2 样品前处理
样品提取:称取2 g(精确到0.000 1 g)试样于50 mL离心管中,加入10 mL乙腈,涡旋振荡30 s后,超声提取30 min,4 500 r/min离心5 min;吸取上清液于氮吹管中,下层用10 mL乙腈重复提取1 次,合并提取液于氮吹管中,35 ℃氮吹至近干;加入5 mL正己烷,涡旋振荡30 s溶解,待净化。
样品净化:依次用5 mL二氯甲烷和5 mL正己烷活化MIP-PAHs固相萃取柱,将待净化溶液全部上样,用2 mL正己烷洗涤氮吹管并入柱中,用正己烷淋洗2 次,每次3 mL,弃去淋洗液,再用10 mL二氯甲烷洗脱并收集净化液至离心管;35 ℃氮吹至近干,用乙腈定容至1.0 mL,过0.22 μm滤膜,待测。
1.3.3 仪器条件
色谱柱:Waters PAHs C18柱(4.6 mm×250 mm,5 μm);流动相:乙腈和水;柱温35 ℃;流速1.2 mL/min;进样量10 μL;对流动相梯度洗脱程序进行优化。
1.3.4 方法的线性范围、检出限及定量限测定
在优化所得测定条件下,对配制的标准工作液进行测定,以待测PAHs的峰面积(y)为纵坐标,各PAHs的质量浓度(x)为横坐标,绘制标准曲线。在空白基质中依次加入较低质量浓度的标准溶液后进行测定,以3 倍信噪比(RS/N=3)和10 倍信噪比(RS/N=10)分别确定方法的检出限和定量限。
1.3.5 方法的回收率和精密度测定
称取2 g(精确到0.000 1 g)空白试样,分别进行5.0、10.0、25.0 μg/kg 3 个加标水平的基质加标回收实验,按照1.3.2节进行样品前处理,并进行HPLC-FLD分析,计算平均回收率和方法精密度(相对标准偏差(relative standard deviation,RSD))。每个添加水平均平行测定6 次。
2 结果与分析
2.1 样品净化方式的选择
称取空白样品,按照10.0 μg/kg的添加水平进行加标回收实验,比较MIP-PAHs和以900 mg硫酸镁、100 mg N-丙基乙二胺(primary secondary amine,PSA)、100 mg C18为填料的净化管2 种净化方式对烤肉样品的净化效果。
表1 2 种净化方式回收率的比较
Table 1 Comparison of recovery rates of two purification methods

%目标物 MIP-PAHs 以900 mg硫酸镁、100 mg PSA、100 mg C18为填料的净化管苊80.6 60.7芴95.5 71.8芘96.4 73.2菲94.3 72.5蒽91.6 70.6萘89.5 73.4荧蒽 89.1 71.1苯并(a)蒽 86.1 64.8苯并(a)芘 95.8 75.7二苯并(a,h)蒽 89.9 74.0苯并(b)荧蒽 90.3 73.3茚并(1,2,3-c,d)芘 81.3 61.9苯并(k)荧蒽 94.5 75.0苯并(g,h,i)苝 84.7 62.9䓛93.5 72.6
由表1可知,MIP-PAHs和以900 mg硫酸镁、100 mg PSA、100 mg C18为填料的净化管净化的回收率分别为80.6%~95.8%和60.7%~75.7%,MIP-PAHs固相萃取柱的分析结果优于以900 mg硫酸镁、100 mg PSA、100 mg C18为填料的净化管,因此选择MIP-PAHs净化。
2.2 色谱条件的优化
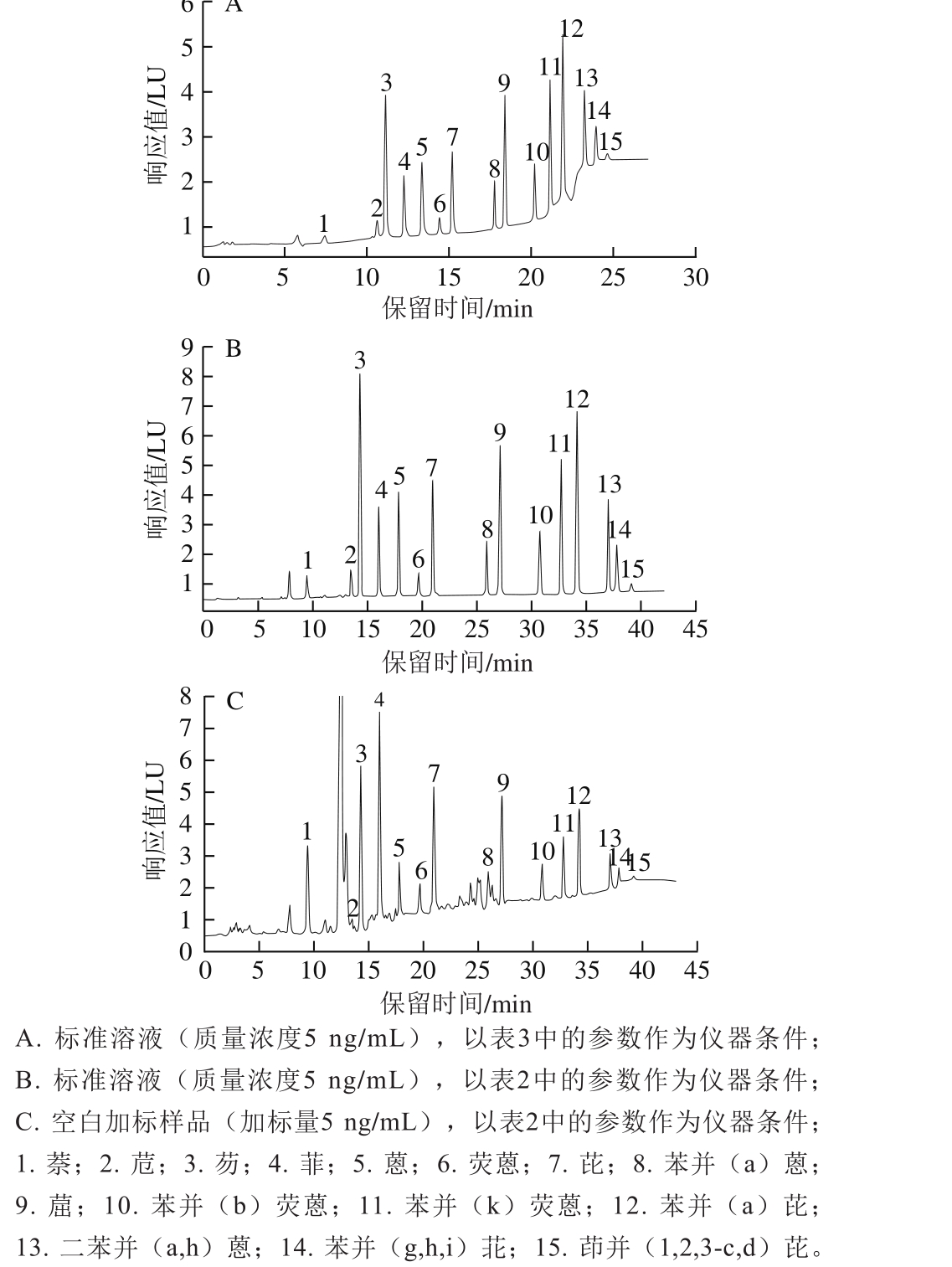
流速和流动相的不同配比直接影响PAHs的出峰时间及分离效果,考察表2~3中的2 种仪器条件对PAHs分离效果的影响。由图1可知,以表3中的参数作为仪器条件时,标准溶液色谱图的基线不平,以表2中的参数作为仪器条件时,标准溶液色谱图的基线平稳,且空白加标样品可以实现较好地分离。
表2 流动相洗脱梯度、流速及荧光检测器梯度(1)
Table 2 Mobile phase gradient program, fl ow rate and fl uorescence detection gradient (1)
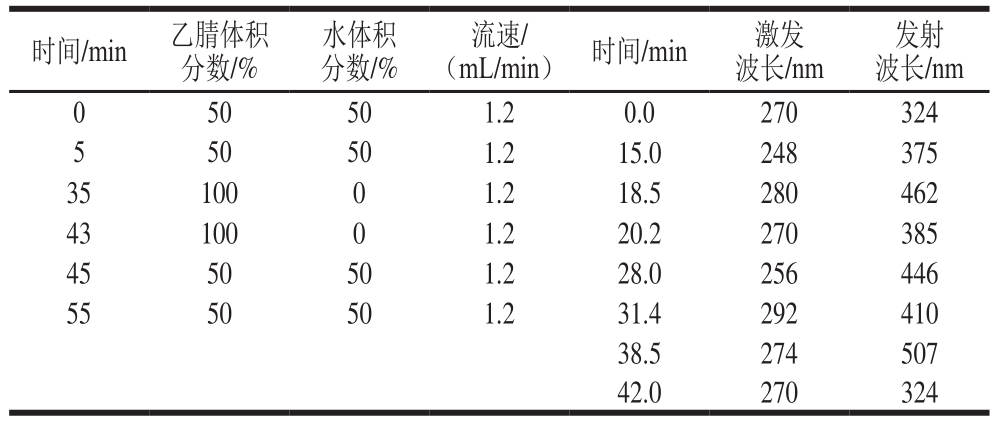
时间/min 乙腈体积分数/%水体积分数/%(mL/min) 时间/min 激发波长/nm发射波长/nm 0 50 50 1.2 0.0 270 324 5 50 50 1.2 15.0 248 375 35 100 0 1.2 18.5 280 462 43 100 0 1.2 20.2 270 385 45 50 50 1.2 28.0 256 446 55 50 50 1.2 31.4 292 410 38.5 274 507 42.0 270 324流速/
表3 流动相洗脱梯度、流速及荧光检测器梯度(2)
Table 3 Mobile phase gradient program, fl ow rate and fl uorescence detection gradient (2)
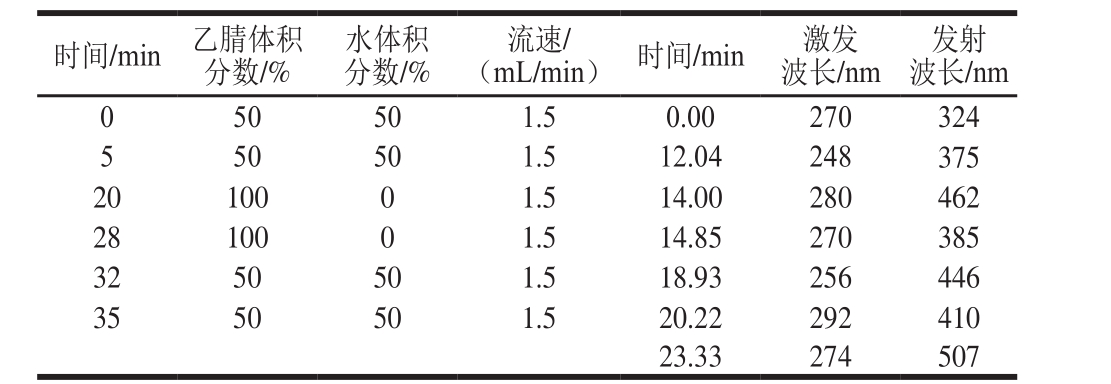
时间/min 乙腈体积分数/%发射波长/nm 0 50 50 1.5 0.00 270 324 5 50 50 1.5 12.04 248 375 20 100 0 1.5 14.00 280 462 28 100 0 1.5 14.85 270 385 32 50 50 1.5 18.93 256 446 35 50 50 1.5 20.22 292 410 23.33 274 507水体积分数/%(mL/min)时间/min激发波长/nm流速/
2.3 方法的线性范围、检出限及定量限
表4 方法的线性范围、检出限及定量限
Table 4 Linear ranges, LODs and LOQs of the method
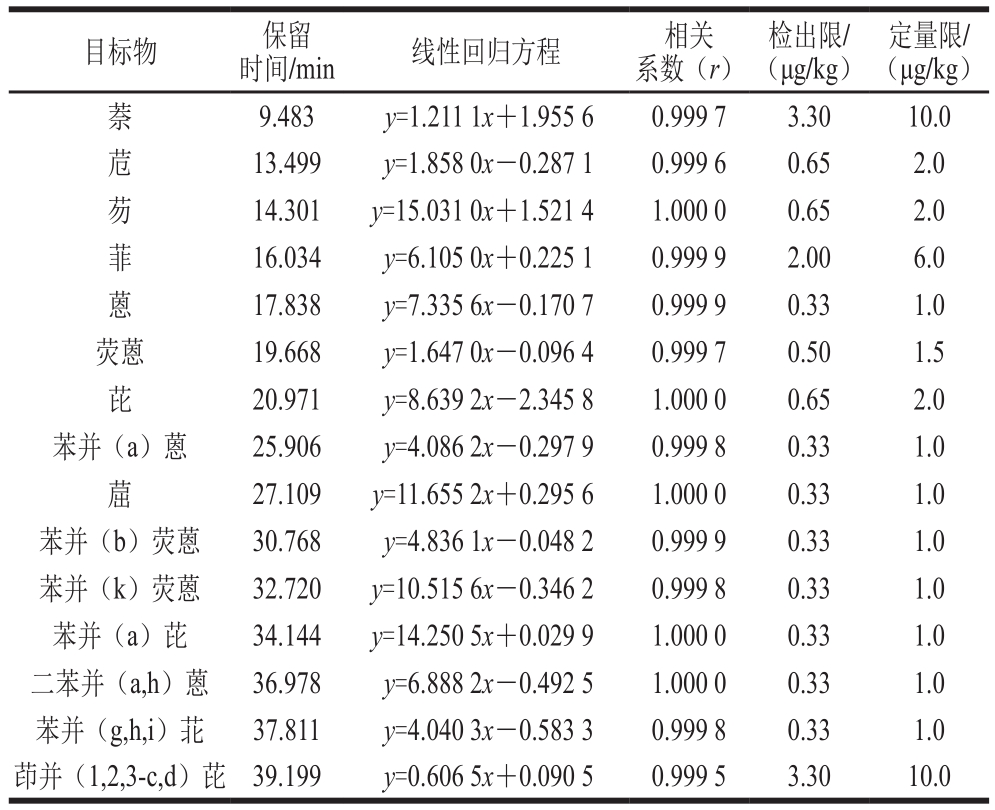
定量限/(μg/kg)萘9.483 y=1.211 1x+1.955 6 0.999 7 3.30 10.0苊13.499 y=1.858 0x-0.287 1 0.999 6 0.65 2.0芴14.301 y=15.031 0x+1.521 4 1.000 0 0.65 2.0菲16.034 y=6.105 0x+0.225 1 0.999 9 2.00 6.0蒽17.838 y=7.335 6x-0.170 7 0.999 9 0.33 1.0荧蒽 19.668 y=1.647 0x-0.096 4 0.999 7 0.50 1.5芘20.971 y=8.639 2x-2.345 8 1.000 0 0.65 2.0苯并(a)蒽 25.906 y=4.086 2x-0.297 9 0.999 8 0.33 1.0䓛27.109 y=11.655 2x+0.295 6 1.000 0 0.33 1.0苯并(b)荧蒽 30.768 y=4.836 1x-0.048 2 0.999 9 0.33 1.0苯并(k)荧蒽 32.720 y=10.515 6x-0.346 2 0.999 8 0.33 1.0苯并(a)芘 34.144 y=14.250 5x+0.029 9 1.000 0 0.33 1.0二苯并(a,h)蒽 36.978 y=6.888 2x-0.492 5 1.000 0 0.33 1.0苯并(g,h,i)苝 37.811 y=4.040 3x-0.583 3 0.999 8 0.33 1.0茚并(1,2,3-c,d)芘 39.199 y=0.606 5x+0.090 5 0.999 5 3.30 10.0目标物 保留时间/min线性回归方程相关系数(r)检出限/(μg/kg)
由表4可知,用HPLC-FLD法测定时,PAHs在质量浓度1~50 ng/mL线性范围内均呈良好的线性关系,r>0.999 5,方法检测限为0.33~3.30 μg/kg,定量限为1.0~10.0 μg/kg。
2.4 方法的回收率和精密度
表5 方法回收率和RSDs(n=6)
Table 5 Recovery and precision (RSDs) of the method (n= 6)

%加标量5.0 μg/kg 加标量10.0 μg/kg 加标量25.0 μg/kg回收率 RSD 回收率 RSD 回收率 RSD苊未检出 72.6 5.5 80.6 4.7 83.3 3.5芴未检出 85.6 2.5 95.5 2.0 97.3 1.2芘未检出 87.2 2.3 96.4 1.6 98.6 1.1菲未检出 85.2 2.5 94.3 2.3 95.8 1.4蒽未检出 84.6 2.7 91.6 2.6 93.8 1.5萘未检出 80.1 4.0 89.5 2.8 91.6 1.8荧蒽 未检出 81.2 3.2 89.1 2.9 92.3 1.7苯并(a)蒽 未检出 80.1 3.9 86.1 3.2 90.2 2.1苯并(a)芘 未检出 90.5 1.8 96.8 1.5 98.8 1.0二苯并(a,h)蒽 未检出 80.2 3.0 89.9 2.2 91.0 2.0苯并(b)荧蒽 未检出 80.0 2.9 90.3 2.7 92.3 1.6茚并(1,2,3-c,d)芘 未检出 71.1 5.8 81.3 4.5 83.0 3.6苯并(k)荧蒽 未检出 86.2 2.4 94.5 2.2 96.1 1.3苯并(g,h,i)苝 未检出 80.2 3.8 84.7 3.8 90.4 1.9䓛未检出 82.3 3.1 93.5 2.1 96.6 1.4目标物 样品中含量/(μg/kg)
由表5可知,HPLC-FLD法中各PAHs在5.0、10.0、25.0 μg/kg 3 个加标水平的回收率分别为71.1%~90.5%、80.6%~96.8%及83.0%~98.8%,RSD分别为1.8%~5.8%、1.5%~4.7%及1.0%~3.6%,表明方法准确度和精密度均满足分析要求。
表6 样品PAHs含量测定结果
Table 6 PAHs contents of real samples

μg/kg样品 苊 芴 芘 菲 蒽 萘 荧蒽蒽苯并(a)蒽苯并(a)芘二苯并(a,h)蒽苯并(b)荧蒽茚并(1,2,3-c,d)芘苯并(k)荧蒽苯并(g,h,i)苝 䓛 PAH4总量烤鸭1 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0烤鸭2 2.5 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 7.4 7.4烤鸭3 0.0 2.3 3.3 11.7 1.3 9.9 3.2 0.0 0.0 0.0 0.0 0.0 0.0 0.0 1.1 1.1烤鸭4 3.8 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0烤鸭5 1.4 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0烤鸭6 3.9 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0烤鸭7 0.0 0.0 0.0 2.9 0.0 11.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0烤鸭8 0.0 5.0 6.1 17.1 2.9 11.4 5.4 1.4 0.0 0.0 0.0 0.0 0.0 0.0 1.2 2.6烤鸭9 0.0 2.5 1.4 7.3 1.2 12.5 1.6 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0烤鸭10 0.0 8.3 11.1 33.7 7.0.0 37.6 11.2 1.8 0.0 0.0 1.3 0.0 0.0 0.0 2.1 5.2烤鸭11 0.0 3.3 2.6 12.5 1.8 13.5 3.4 0.0 0.0 0.0 0.0 0.0 0.0 0.0 1.2 1.2烤鸭12 0.0 4.1 7.9 15.5 3.8 38.6 8.1 1.3 0.0 0.0 1.2 0.0 0.0 0.0 1.3 3.8烤鸭13 0.0 0.0 37.2 0.0 33.0 0.0 32.9 8.4 3.6 0.0 4.2 0.0 0.0 1.4 0.0 16.2烤鸭14 0.0 2.4 2.9 5.6 1.4 7.0 2.3 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0烤鸭15 0.0 1.9 2.6 5.6 1.4 7.0 2.3 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0烤鸡肉1 29.9 8.1 0.0 6.5 0.0 24.7 0.0 4.3 1.9 0.0 2.7 0.0 0.0 1.1 5.6 14.5烤鸡肉2 17.1 0.0 33.6 0.0 9.6 0.0 0.0 7.3 5.6 1.6 6.4 11.8 2.0 4.1 9.1 28.4烤肉1 0.0 0.0 36.6 0.0 19.6 0.0 29.5 9.1 7.9 2.0 8.6 13.1 2.9 5.0 7.0 32.6烤肉2 0.0 0.0 2.7 14.2 0.0 0.0 0.0 7.0 3.3 1.5 3.7 1.3 2.3 0.0 0.0 14.0烤羊肉1 0.0 0.0 0.0 0.0 0.0 0.0 0.0 5.4 3.0 0.0 3.7 19.5 1.4 1.9 6.8 18.9烤羊肉2 15.3 0.0 17.7 0.0 19.5 0.0 23.8 0.0 1.6 0.0 1.7 0.0 0.0 0.0 4.4 7.7烤牛肉1 0.0 1.0.0 0.0 2.6 13.4 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 1.6 1.6烤牛肉2 15.8 0.0 22.9 0.0 21.1 0.0 28.3 4.1 1.6 0.0 2.6 0.0 0.0 0.0 4.8 13.1烤牛肉3 0.0 0.0 0.0 0.0 24.6 0.0 1.4 6.6 0.0 0.0 0.0 0.0 0.0 0.0 2.8 9.4
2.5 实际样品测定
按照1.3.2节处理样品,将处理好的样品在优化所得条件下进行测定,外标法定量。
由表6可知:15 种PAHs在24 份烤肉样品中均有检出,其中烤鸡肉2和烤肉1中苯并(a)芘含量大于5.0 μg/kg;烤鸭13、烤肉2和烤羊肉1中苯并(a)芘含量大于2.0 μg/kg,且PAH4(䓛、苯并(a)蒽、苯并(b)荧蒽、苯并(a)芘)总量均大于12.0 μg/kg;烤鸡肉1和烤牛肉2中苯并(a)芘含量小于2.0 μg/kg,但PAH4总量均大于12.0 μg/kg;24 份烤肉样品中有2 份不符合我国标准,7 份不符合欧盟标准。由此可见,单一控制苯并(a)芘的含量不足以保证烤肉的质量,为提高其安全性,且与国际接轨,应尽快提高我国熏、烧、烤肉制品中PAHs的限量标准。
3 结 论
比较MIP-PAHs和以900 mg硫酸镁、100 mg PSA、100 mg C18为填料的净化管2 种净化方式对烤肉样品的净化效果,结果表明:采用MIP-PAHs净化时,空白样品加标回收率高,且能减少其他物质对目标物的干扰。流速和流动相的不同配比直接影响PAHs的出峰时间及分离效果。在进行预实验时,参照GB 5009.265—2016《食品安全国家标准 食品中多环芳烃的测定》中的色谱条件,但标准溶液中的15 种PAHs目标物分离不理想,且基线不平,最终通过不断摸索确定了本研究中的色谱条件。
本研究用少量乙腈超声提取样品后,采用MIP-PAHs净化,净化后的样品进行HPLC-FLD检测。结果表明,烤肉中15 种PAHs的加标回收率为71.1%~98.8%,RSD为1.0%~5.8%,该方法高效、快速、灵敏度高,可以用于烤肉中15 种PAHs的定量分析。
参考文献:
[1] WANG Jizhong, ZHU Chengzhu, CHEN Tianhu. PAHs in the Chinese environment: levels, inventory mass, source and toxic potency assessment[J]. Environmental Science Processes and Impacts, 2013,15(6): 1104-1112. DOI:10.1039/c3em00070b.
[2] NAVARRO P, CORTAZAR E, BARTOLOM L. Comparison of solid phase extraction, saponification and gel permeation chromatography for the clean-up of microwave assisted biological extracts in the analysis of polycyclic aromatic hydrocarbons[J]. Journal of Chromatography A,2006(1/2): 10-16. DOI:10.1016/j.chroma.2006.06.063.
[3] WANG Lili, YANG Zhifeng, NIU Junfeng, et al. Characterization,ecological risk assessment and source diagnostics of polycyclic aromatic hydrocarbons in water column of the Yellow River Delta,one of the most plenty biodiversity zones in the world[J]. Journal of Hazardous Materials, 2009, 169(1/3): 460-465. DOI:10.1016/j.jhazmat.2009.03.125.
[4] 原文婷, 梁峰, 高占啟, 等. 固相微萃取-气相色谱-质谱联用测定水体中多环芳烃[J]. 环境化学, 2014, 33(5): 819-825. DOI:10.7524/j.issn.0254-6108.2014.05.012.
[5] 陈慧, 黄要红, 蔡铁云. 固相萃取-气相色谱/质谱法测定水中多环芳烃[J]. 环境污染与防治, 2004, 26(1): 72-74. DOI:10.15985/j.cnki.1001-3865.2004.01.033.
[6] 陈硕, 韩宗勋, 全燮, 等. 毛细管固相微萃取-液相色谱法测定水中的多环芳烃[J]. 分析化学, 2003, 31(2): 171-174. DOI:10.3321/j.issn:0253-3820.2003.02.010.
[7] 金梦云, 邢新丽, 柯艳萍, 等. 神农架大九湖大气中的多环芳烃[J].环境科学, 2017, 38(5): 1760-1768. DOI:10.13227/j.hjkx.201609235.
[8] 张玉凤, 宋永刚, 田金, 等. 辽东湾大气中多环芳烃的含量组成及气粒分配[J]. 环境科学, 2018, 39(4): 1527-1536. DOI:10.13227/j.hjkx.201708148.
[9] 刘斐, 段凤魁, 李海蓉, 等. 固相微萃取-气相色谱串联质谱法检测北京大气细颗粒物中的多环芳烃[J]. 分析化学, 2015, 43(4): 540-546.DOI:10.11895/j.issn.0253-3820.140942.
[10] LONG Zhao, HONG Hou, SHANGGUAN Yuxian, et al. Occurrence,sources, and potential human health risks of polycyclic aromatic hydrocarbons in agricultural soils of the coal production area surrounding Xinzhou, China[J]. Ecotoxicology and Environmental Safety, 2014, 108: 120-128. DOI:10.1016/j.ecoenv.2014.05.034.
[11] 张俊叶, 俞菲, 俞元春. 中国主要地区表层土壤多环芳烃含量及来源解析[J]. 生态环境学报, 2017, 26(6): 1059-1067. DOI:10.16258/j.cnki.1674-5906.2017.06.020.
[12] 李拥军, 黎小鹏, 李盛安, 等. QuEChERS前处理-GC-MS法测定土壤中16 种多环芳烃[J]. 广东化工, 2016, 43(13): 269-271. DOI:10.3969/j.issn.1007-1865.2016.13.131.
[13] 张东东, 刘玉兰, 马宇翔, 等. SPE净化-同位素稀释-GC-MS法检测食用油脂中16 种多环芳烃[J]. 粮食与油脂, 2016, 29(1): 53-59.DOI:10.3969/j.issn.1008-9578.2016.01.015.
[14] 赵佳莹, 李晓敏, 卢晓华, 等. 高效液相色谱-荧光检测法测定橄榄油中4 种多环芳烃[J]. 色谱, 2017, 35(7): 748-754. DOI:10.3724/SP.J.1123.2017.03040.
[15] 王建华. 不同加工过程花生油中16 种多环芳烃(PAHs)的含量变化[J]. 食品科技, 2013, 38(5): 183-187. DOI:10.13684/j.cnki.spkj.2013.05.031.
[16] 吕爱娟, 时磊, 蔡小虎, 等. QuEChERS-高效液相色谱法快速测定稻谷和土壤中16 种多环芳烃[J]. 理化检验, 2016, 52(9): 1017-1021.DOI:10.11973/lhjy-hx201609005.
[17] OKUDA T, NAOI D, TENMOKU M, et al. Polycyclic aromatic hydrocarbons (PAHs) in the aerosol in Beijing, China, measured by aminopropylsilane chemically-bonded stationary-phase column chromatography and HPLC/f l uorescence detection[J]. Chemosphere,2006, 65(3): 427-435. DOI:10.1016/j.chemosphere.2006.01.064.
[18] 康翠欣, 宋雅东, 朱静璇, 等. HPLC和GC-MS/MS测定食用油中4 种多环芳烃的方法比较[J]. 食品科技, 2018, 43(3): 294-299.DOI:10.13684/j.cnki.spkj.2018.03.056.
[19] 罗世霞, 朱淮武, 张笑一. 固相微萃取-气相色谱法联用分析饮用水源水中的16 种多环芳烃[J]. 农业环境科学学报, 2008, 27(1): 395-400.DOI:10.3321/j.issn:1672-2043.2008.01.074.
[20] 刘彬, 刘云虎. 食品塑料包装中18 种多环芳烃的气相色谱-质谱联用检测方法研究[J]. 食品科技, 2018, 43(6): 317-321. DOI:10.13684/j.cnki.spkj.2018.06.058.
[21] ONG R, LUNDSTEDT S, HAGLUND P, et al. Pressurized liquid extraction-comprehensive two-dimensional gas chromatography for fast-screening of polycyclic aromatic hydrocarbons in soil[J].Journal of Chromatography A, 2003(1/2): 221-232. DOI:10.1016/j.chroma.2003.07.006.
[22] MARTINEZ E, GROS M, LACORTE S, et al. Simplified procedures for the analysis of polycyclic aromatic hydrocarbons in water,sediments and mussels[J]. Journal of Chromatography A, 2004(2):181-188. DOI:10.1016/j.chroma.2004.07.003.
[23] 石龙凯, 刘玉兰. 液相色谱-串联质谱法检测食用油脂中多环芳烃[J]. 中国粮油学报, 2015, 30(12): 114-119. DOI:10.3969/j.issn.1003-0174.2015.12.021.
[24] RAMIREZ C E, WANG C T, GARDINALI P R. Fully automated trace level determination of parent and alkylated PAHs in environmental waters by online SPE-LC-APPI-MS/MS[J]. Analytical and Bioanalytical Chemistry, 2014, 406(1): 329-344. DOI:10.1007/s00216-013-7436-6.
[25] 赵波, 黎玉清, 张素坤, 等. 气相色谱-三重四极杆串联质谱法检测环境空气中的多环芳烃[J]. 色谱, 2014, 32(9): 960-966. DOI:10.3724/SP.J.1123.2014.05027.
[26] 林玉君, 贾静, 吴建刚, 等. 索氏提取-气相色谱三重四极杆串联质谱联用法测定空气中的多环芳烃[J]. 福建分析测试, 2015, 24(3): 31-34.DOI:10.3969/j.issn.1009-8143. 2015.03.07.
[27] 毕鸿亮, 张浩原, 孙翠香, 等. 蔬菜中多环芳烃的GC-MS分析[J]. 分析测试学报, 2007, 26(4): 530-536. DOI:10.3969/j.issn.1004-4957.2007.04.019.
[28] 崔立迁, 王欣. 气相色谱质谱法测定聚氨酯塑胶跑道中多环芳烃[J].分析试验室, 2016, 35(9): 1099-1102. DOI:10.13595/j.cnki.issn1000-0720.2016.0249.
[29] 李荫, 柳叶, 孙晓伟, 等. 多环芳烃的样品前处理技术研究进展[J]. 环境化学, 2015, 34(8): 1460-1469. DOI:10.7524/j.is sn.0254-6108.2015.08.2015020406.
[30] 贾敬香, 潘铁英, 杜一平, 等. 超声波萃取-GC/MS法测定橡胶轮胎中的多环芳烃[J]. 环境污染与防治, 2008, 30(3): 54-61.DOI:10.3969/j.issn.1001-3865.2008.03.016.
Determination of 15 Polycyclic Aromatic Hydrocarbons in Barbecued Meat by Molecularly Imprinted Solid-Phase Extraction Combined with High Performance Liquid Chromatography-Fluorescence Detection
YANG Wenwu1, TAN Shunzhong1, GUO Ya1,*, ZHOU Nong2
(1.Chongqing Wanzhou Institute for Food and Drug Control, Chongqing 404000, China;2.College of Biology and Food Engineering, Chongqing Three Gorges University, Chongqing 404000, China)
Abstract:A method for simultaneous determination of 15 polycyclic aromatic hydrocarbons (PAHs) in barbecued meat was developed by high performance liquid chromatography with fluorescence detection (HPLC-FLD). Samples were ultrasonically extracted, and the extract was purified by molecularly imprinted solid-phase extraction (MISPE), separated by HPLC and quantified by external standard method. The results showed that the concentration of 15 PAHs in the range from 1 to 50 ng/mL was linear with the chromatographic peak area with correlation coefficients (r) more than 0.999 5. Average recoveries at spiking levels of 5.0, 10.0 and 25.0 μg/kg ranged from 71.1% to 98.8% with relative standard deviations (RSDs)from 1.0% to 5.8%. The detection limits (RS/N= 3) varied from 0.33 to 3.30 μg/kg and the quantitation limits (RS/N= 10) from 1.0 to 10.0 μg/kg.
Keywords:polycyclic aromatic hydrocarbons; barbecued meat; high performance liquid chromatography-fluorescence detection; molecular imprinting column of PAHs; external standard quantitation
YANG Wenwu, TAN Shunzhong, GUO Ya, et al. Determination of 15 polycyclic aromatic hydrocarbons in barbecued meat by molecularly imprinted solid-phase extraction combined with high performance liquid chromatography-fluorescence detection[J]. Meat Research, 2018, 32(11): 47-52. DOI:10.7506/rlyj1001-8123-201811008. http://www.rlyj.pub
引文格式:阳文武, 谭顺中, 郭娅, 等. 多环芳烃分子印迹柱-高效液相色谱荧光检测法快速测定烤肉中15 种多环芳烃[J]. 肉类研究, 2018, 32(11): 47-52. DOI:10.7506/rlyj1001-8123-201811008. http://www.rlyj.pub
文章编号:1001-8123(2018)11-0047-06
文献标志码:A
中图分类号:TS251.7
DOI:10.7506/rlyj1001-8123-201811008
*通信作者简介:郭娅(1982—),女,主管中药师,本科,研究方向为食品药品检测技术。E-mail:603725622@qq.com
第一作者简介:阳文武(1986—),男,主管中药师,本科,研究方向为食品药品检测技术。E-mail:oyww2008@163.com
基金项目:2017年度重庆市食品药品监督管理局食品安全风险监测项目(20171122)
收稿日期:2018-07-13