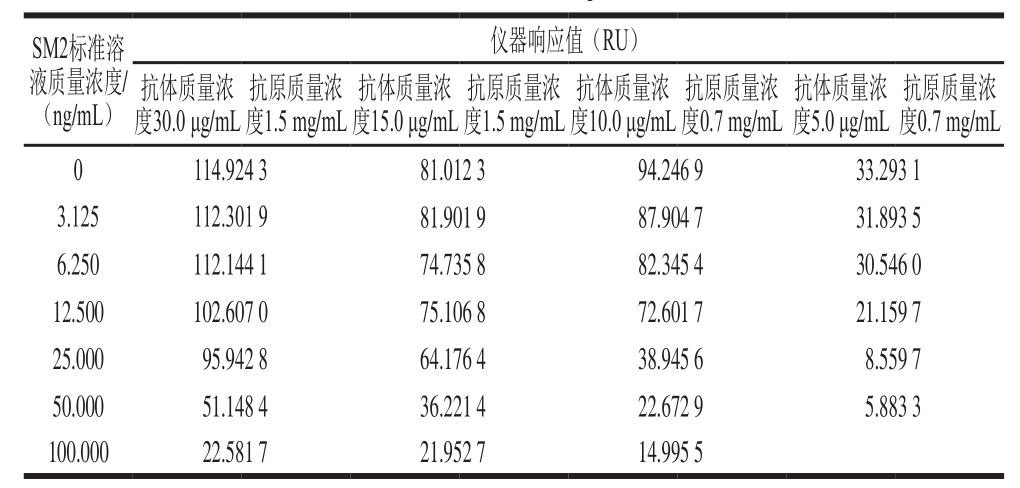
表1 不同质量浓度抗原、抗体条件下的仪器响应值
Table 1 Instrumental response at different concentrations of antigen and antibody
俞 婧1,范素芳1,*,李 强1,马俊美1,石伟杰1,孟志娟1,张 腾2,张 岩1,*
(1.河北省食品检验研究院,河北省食品安全重点实验室,河北 石家庄 050091;2.北京中龙益诚科技有限公司,北京 100071)
摘 要:建立基于表面等离子体共振技术的猪肉中磺胺二甲嘧啶(sulfamethazine,SM2)的测定方法。以纳米金材料为媒介,将SM2的抗原连接到传感器芯片表面,优化芯片固定抗原质量浓度和测定溶液中抗体的质量浓度,并对标准曲线进行优化。结果表明:添加水平为10、20、100 μg/kg时,方法回收率为87.6%~107.4%,相对标准偏差小于11%;对实际样品进行测定,并经液相色谱-质谱/质谱法确证,表明该方法可用于猪肉中SM2的快速筛查分析。
关键词:表面等离子体共振;猪肉;磺胺二甲嘧啶
磺胺类药物是一类具有对氨基苯磺酰胺的药物总称[1],具有抗菌谱广、稳定性强等优点,广泛应用于畜牧业和兽医临床治疗[2-3]。磺胺二甲嘧啶(sulfamethazine,SM2)具有抗菌力强、毒性小等优点,是畜牧养殖中应用最为广泛的磺胺类药物之一[4]。磺胺类药物的毒性较高,而且半衰期比较长[5],长期食用被磺胺类药物污染的水和食物,人体会产生耐药性并能引发过敏反应[6]。磺胺类药物的残留情况日益受到关注,许多国家和地区制定了磺胺类药物的最大残留限量[7]。国际食品法典委员会和欧美许多国家规定动物组织中磺胺类药物的残留总量不能超过100 μg/kg[8],日本规定不能超过20 μg/kg[9],我国农业部第235号公告规定,牛乳中SM2的最大残留限量为25 μg/kg,动物源食品中磺胺类药物总量的最大残留限量为100 μg/kg[2,10-11]。
目前,磺胺类药物的检测方法主要有液相色谱法[4-5,7,12]、液相色谱-串联质谱法[1-3,10]、液相色谱-高分辨质谱法[8-9]等传统的仪器分析法和酶联免疫法[13]、化学发光微粒子免疫法[11]、分子印迹二维光子晶体水凝胶传感器法[6]等快筛方法。仪器分析方法准确、灵敏,但前处理过程繁琐、操作专业性强、仪器设备昂贵,不适合基层推广应用。酶联免疫法检测时间较长,且需要二抗标记,底物和硫酸对操作人员有害。表面等离子体共振(surface plasmon resonance,SPR)传感器是一种常用于生物大分子探测与分析的消逝波传感器,具有灵敏度高、实时性好、无需标记、样品用量少、样品制备时间短、便携等优点[14-15]。SPR已经广泛应用于医疗诊断和环境监测,如蛋白质、血糖、微生物、气体检测[16]、血清中转铁蛋白检测[17]和生物医学、环境中小分子检测[18]以及食品安全领域检测,如牛乳中三聚氰胺和磺胺[19-21]、花生中黄曲霉毒素B1[22]、油品种类[23]、β-兴奋剂[24-26]、水样品中莠去津[27]、肉类中泰乐霉素和磺胺[28-29]、食源性化学危害物检测等[30]。本研究采用SPR技术,利用竞争免疫反应原理,建立猪肉样品中SM2的快速筛查方法,为现场抽检提供一种新的方法。
SM2标准品(纯度≥99%)、牛血清白蛋白(bovine serum albumin,BSA) 美国Sigma公司;SM2单克隆抗体和SM2-BSA偶联物 河北省科学院;实验用水均为屈臣氏纯净水。
猪肉样品购自当地超市,用组织粉碎机磨碎后备用。
生物芯片、YC-SPR-A1生物分子互作仪 北京中龙益诚科技有限公司;BPX-162恒温培养箱 上海博迅实业有限公司;3K 15离心机 德国Sigma公司。
1.3.1 SM2生物芯片的制备
生物芯片表面修饰有L-半胱氨酸连接的纳米金(Aunanoparticles,Au-NP)颗粒。取出Au-NP芯片,用去离子水冲洗,清洗表面,氮吹干燥;取80 μL 1.0 mg/mL的SM2-BSA,滴到Au-NP芯片表面,37 ℃孵育1 h,用去离子水冲洗Au-NP芯片,氮吹干燥;Au-NP芯片表面加3% BSA,封闭未作用位点,避免非特异吸附,芯片用去离子水冲洗后37 ℃孵育1 h;取出芯片,氮气吹干后待用。
1.3.2 SM2芯片固定抗原浓度及测试液抗体浓度的选择
在Au-NP芯片表面修饰不同质量浓度的SM2-BSA(0.7、1.0、1.5 mg/mL),按1.3.1节中的步骤制备芯片,配制不同质量浓度(5、10、15、30 μg/mL)抗体标准溶液,对芯片进行测试,综合考虑标准曲线的线性范围,选择最终的抗原质量浓度和抗体质量浓度。
1.3.3 再生条件和进样条件
分别考察10 mmol/L Gly(甘氨酸)-HCl(pH 2.0~2.5)、50 mmol/L NaOH和100 mmol/L NaOH作为再生液时仪器的响应情况,再生液体积100 μL,流速400 μL/min,用芯片的洗脱结果和再生次数评价再生效果。样品测定时的进样体积为200 μL,进样速率为20 μL/min。每次的样品测定时间为12.5 min。
1.3.4 样品前处理
称取(2.00±0.02) g研磨好的猪肉样品于50 mL离心管中,加入10 mL乙酸乙酯,涡旋1 min,30 ℃条件下超声辅助提取20 min,9 500 r/min条件下离心5 min;取5 mL上清液,于50 ℃条件下旋转蒸发至近干;加入1 mL正己烷复溶样品,并转移至5 mL离心管中,加入等体积的0.01mol/L PBS缓冲液,涡旋混匀1 min,9 500 r/min条件下离心5 min;取下层水相,与等体积抗体混合均匀后,待测。
1.3.5 标准曲线的绘制
猪肉样品基质较复杂,非特异性吸附较多,按照1.3.4节的样品前处理方法处理空白猪肉样品,得到空白基质提取液,用该空白基质提取液配制不同质量浓度的SM2标准溶液,将SM2标准溶液与等质量浓度的抗体等体积混合,混合溶液中SM2的最终质量浓度分别为0、6.25、10.00、12.50、25.00 ng/mL。测定时的进样体积200 μL,进样流速20 μL/min,读取各样品的SPR响应值。
1.3.6 加标回收实验
在(2.00±0.02) g猪肉中加入质量浓度为10 μg/mL的SM2标准溶液,添加水平分别为10、20、100 μg/kg,每个水平3 个平行。样品经前处理后,与抗体溶液等体积混合,进样,测得响应值,通过标准曲线计算实际测得浓度,并计算回收率。
标准曲线制作和数据统计分析采用Microsoft Excel 2010软件,图形绘制采用OriginLab 8.0软件。
由表1可知,虽然当抗体和抗原质量浓度增大时,仪器响应值相应增大,但SM2标准溶液的质量浓度较小时,由于抗体质量浓度过大,梯度不明显,因此抗体及抗原的质量浓度不宜过大。抗原质量浓度为1.5 mg/mL,分别通入质量浓度为10.0、15.0、30.0 μg/mL的抗体溶液,仪器响应值分别为69.732、81.125、118.326。在抗体质量浓度为30.0 μg/mL时,仪器响应值最大,但考虑到抗体成本问题,选取15.0 μg/mL的抗体作为制作标准曲线时的反应浓度。在3 片芯片上分别修饰1.5、1.0、0.7 mg/mL的SM2-BSA,通入15.0 μg/mL的抗体,仪器响应值分别为82.306、67.325、62.475,可以看出,随着抗原质量浓度的增大,抗体的反应响应值也有一定程度的增大。
表1 不同质量浓度抗原、抗体条件下的仪器响应值
Table 1 Instrumental response at different concentrations of antigen and antibody

芯片固定抗原质量浓度及测试液抗体质量浓度的确定还会影响方法的灵敏度及线性范围。在抗体质量浓度15.0 μg/mL、抗原质量浓度1.5 mg/mL条件下绘制所得标准曲线方程为y=0.047 0x2-1.099 6x+84.147 0(R2=0.976 8)。SM2标准溶液的质量浓度较小时,响应值区分不明显,这可能是抗体或抗原过量造成的,于是进一步降低抗体和抗原的质量浓度,把抗体质量浓度降为10.0 μg/mL,抗原质量浓度降为0.7 mg/mL,得到标准曲线方程为y=0.014 7x2-2.263 2x+94.721 0(R2=0.983 6)。当抗体和抗原质量浓度均下降时,小质量浓度SM2标准溶液的响应值可以明显区分开,这可能是由于芯片的空间位阻效应变小,抗体的结合效率更高。
对表1中的数据分别作不同处理间显著水平为0.05的成对数据t检验,结果表明,抗体质量浓度为15.0 μg/mL、抗原质量浓度为1.5 mg/mL和抗体质量浓度为10.0 μg/mL、抗原质量浓度为0.7 mg/mL时没有显著差异,其他处理组之间均存在显著差异。因此最终选择抗体质量浓度为10.0 μg/mL,抗原质量浓度为0.7 mg/mL。

图1 SPR检测过程示意图
Fig.1 Schematic diagram of SPR detection process
由图1可知,SPR检测过程分为抗体与芯片表面抗原的结合、解离和再生,以再生后仪器响应值能否回到芯片未结合抗体以前的响应值为判断标准,评价洗脱是否彻底。再生的目的是破坏SM2-BSA与SM2抗体的非共价结合,当选用条件温和的Gly-HCl缓冲液(pH 2.0~2.5)时,SM2-BSA与SM2抗体不能彻底分离;使用50 mmol/L NaOH和100 mmol/L NaOH作为再生液时,通过检测芯片可再生次数与SPR响应值考察2 种再生液的洗脱再生效果,采用最佳抗原、抗体质量浓度。
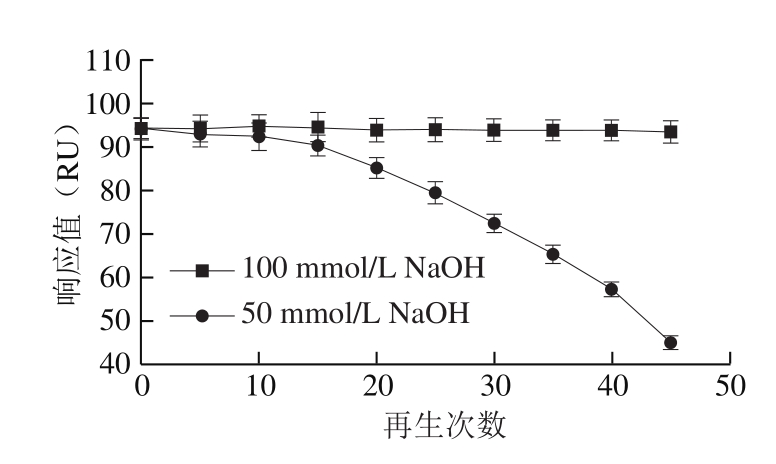
图2 再生次数对SM2芯片响应值的影响
Fig.2 Effect of regeneration cycles on SM2 chip response
由图2可知:使用50 mmol/L NaOH作为再生液时,再生次数达到20 次以上时,SM2芯片活性下降较快,仪器响应值明显降低;而使用100 mmol/L NaOH作为再生液时,再生次数达到45 次时,芯片活性仍较好,仪器重复性良好。因此最终选择100 mmol/L NaOH作为再生液,在再生液体积100 μL、流速400 μL/min时,芯片可重复使用45 次以上。
抗体质量浓度为10.0 μg/mL、抗原质量浓度为0.7 mg/mL时,标准溶液质量浓度范围为0~100 μg/L时拟合的线性方程为y=-0.812 5x+81.954 0(R2=0.795 7),SM2质量浓度达到50 ng/mL时仪器响应值超出线性范围。标准溶液质量浓度范围为0~25 μg/L时拟合的线性方程为y=-2.185 5x+95.726 0(R2=0.986 6),线性关系良好。最终选择标准溶液质量浓度线性范围为0~25 μg/L。
通过多次测定空白样品的本底值来计算仪器的检出限,通过空白样品的本底值计算出的质量浓度水平的标准偏差为σ,3σ对应的质量浓度即为该仪器的检出限。计算得到仪器的检出限为2 ng/mL,对应的方法检出限为4 μg/kg,方法定量限为10 μg/kg,方法的线性范围为10~50 μg/kg,质量浓度超出线性范围时需对样品进行适当稀释。
由表2可知,方法的回收率范围为87.6%~107.4%,RSD均小于11.00%,符合GB/T 27404—2008《实验室质量控制规范 食品理化检测》中对不同添加水平回收率的要求。
表2 方法的回收率
Table 2 Recoveries of the method
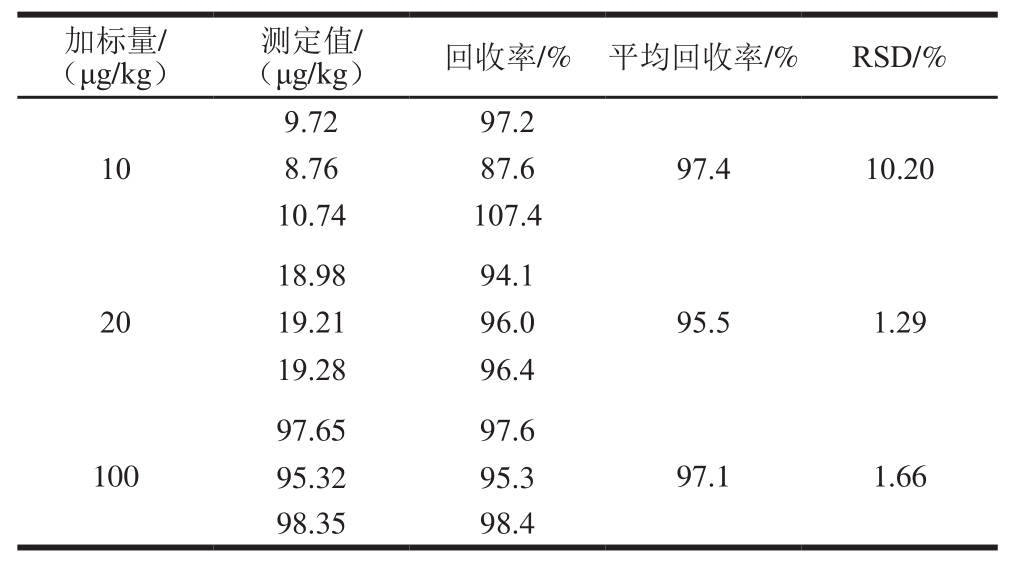
表3 实际样品测定结果
Table 3 Sulfamethazine contents of real samples
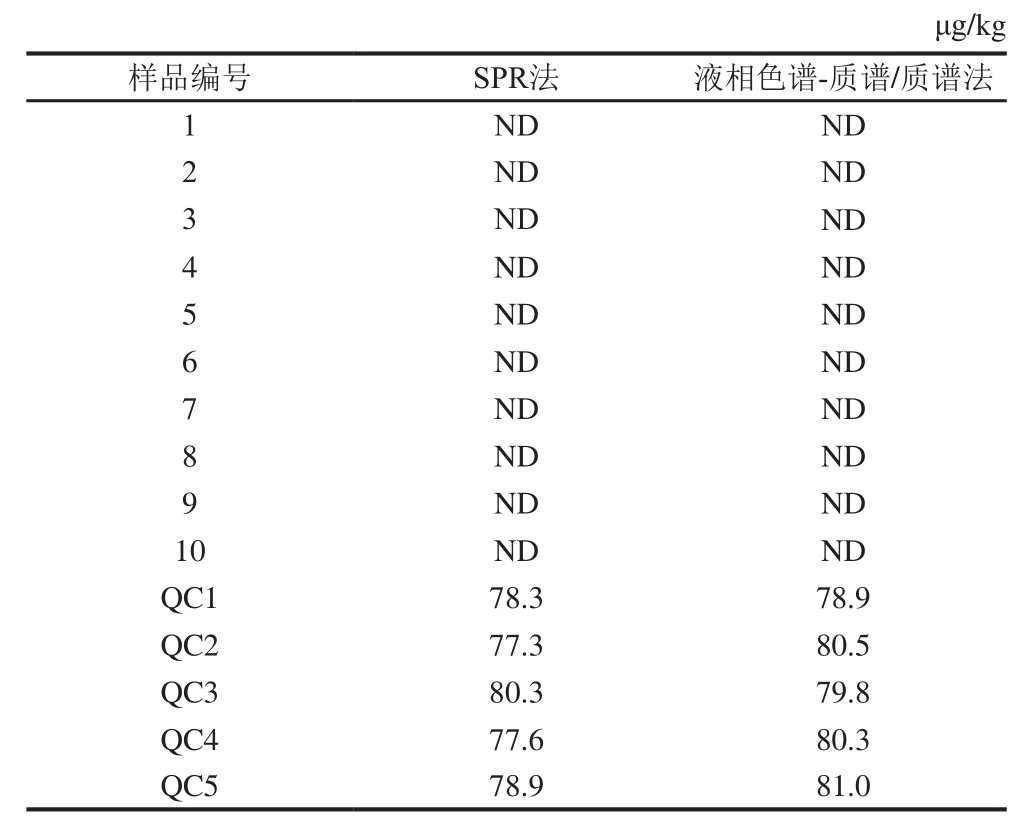
注:QC. 质控样;ND. 未检出。
从超市和菜市场购买10 份猪肉样品,分别采用本研究中的方法和GB/T 21316—2007《动物源性食品中磺胺类药物残留量的测定 液相色谱-质谱/质谱法》中的液相色谱-质谱/质谱法进行测定。由表3可知,检测结果均为未检出,即测定结果低于方法检出限。用本研究中的方法和GB/T 21316—2007本研究中的方法对理论值为80 μg/kg的质控样品进行测定,重复测定5 次,质控样测定结果分别为77.3~80.3 μg/kg和78.9~81.0 μg/kg,说明SPR法与国标方法的测定结果基本一致。
本研究建立了基于SPR技术的猪肉中SM2的测定方法。该方法的线性范围、准确度和精密度均符合GB/T 27404—2008《实验室质量控制规范 食品理化检测》中的相关要求。该生物芯片在优化好的条件下可重复使用40 次以上,另外,该方法比较快速,样品测定时间低于15 min。通过对实际样品及质控样品进行测定,并经液相色谱-质谱/质谱法确证,表明该方法可用于猪肉中SM2的快速筛查分析。
参考文献:
[1] 容裕棠, 张宪臣, 张朋杰, 等. QuEChERS-超高效液相色谱-串联质谱法同时测定蜂蜜中21 种磺胺类药物残留[J]. 食品与发酵工业,2018, 44(4): 226-233. DOI:10.13995/j.cnki.11-1802 /ts.014783.
[2] 高洁, 陈达炜, 丁宇琦, 等. 固相萃取-超高效液相色谱-串联质谱法测定畜产品中残留的22 种磺胺类药物[J]. 中国食品卫生杂志,2018, 30(1): 28-34. DOI:10.13590/j.cjfh.2018.01.006.
[3] 贾涛. 液相色谱串联质谱法测定饲料中磺胺类药物[J]. 饲料研究,2018(2): 58-61. DOI:10.13557/j.cnki.issn1002-2813.2018.02.013.
[4] 林红英, 陆桂萍, 沈子龙. 猪肉中磺胺二甲基嘧啶残留量的高效液相色谱测定[J]. 江苏农业学报, 2006, 22(3): 285-288.
[5] 毛名祝, 张垚. HPLC法测定猪肉中10 种残留磺胺药物[J]. 今日药学, 2018, 28(2): 95-97. DOI:10.12048/j.issn.1674-229X.2018.02.005.
[6] 陈小娟, 刘根起, 任宸锐, 等. 磺胺二甲嘧啶分子印迹二维光子晶体水凝胶传感器的研究[J]. 高等学校化学学报, 2018, 39(2): 212-218.DOI:10.7503/cjcu20170571.
[7] 黄冬梅, 黄宣运, 顾润润, 等. 柱后衍生高效液相色谱法测定虾中14种磺胺类药物残留量[J]. 色谱, 2014, 32(8): 874-879. DOI:10.3724/SP.J.1123.2014.04009.
[8] 贡松松, 顾欣, 曹慧, 等. 高效液相色谱-四极杆飞行时间质谱法快速筛查生鲜牛乳中的14 种磺胺类药物[J]. 分析测试学报, 2014,33(12): 1342-1348.
[9] 徐伟东, 秦峰, 李晓婓, 等. 基质固相分散-高压液相色谱-高分辨质谱法测定猪肉中22 种磺胺类药物的残留[J]. 食品安全质量检测学报, 2013, 4(1): 141-149.
[10] 任丹丹, 谢云峰, 李少晖, 等. 超高效液相色谱-串联质谱法测定畜禽肉中17 种磺胺类药物残留[J]. 食品安全质量检测学报, 2018, 9(4):858-863.
[11] 汪善良, 程茹, 钟新敏, 等. 化学发光微粒子免疫法检测虾肉中磺胺类药物的残留[J]. 安徽农业科学, 2018, 46(8): 170-173.DOI:10.13989/j.cnki.0517-6611.2018.08.052.
[12] 郑斌, 余海霞, 杨会成, 等. 高效液相色谱-在线柱后衍生荧光检测法同时测定水产品中14 种磺胺类药物残留[J]. 食品科学, 2012, 33(4):230-233.
[13] 冯才伟, 朱君红, 王会玲, 等. 酶联免疫法测定猪肉中磺胺类药物的残留[J]. 四川畜牧兽医, 2012(2): 27-29.
[14] 王丽, 万秀美, 高然, 等. 纳米多孔金膜表面等离子体共振传感器的制备与表征[J]. 光学学报, 2018, 38(2): 0228002. DOI:10.3788/A0S201838.0228002.
[15] 齐攀, 李仕萍, 钟金钢, 等. 玉米赤霉烯酮的表面等离子体共振芯片无标记快速测定[J]. 农业机械学报, 2018, 49(5): 355-360.DOI:10.6041/j.issn.1000-1298.2018.05.042.
[16] 郭团. 等离子体共振光纤光栅生物传感器综述[J]. 光学学报, 2018,38(3): 0328006. DOI:10.3788/AOS201838.0328006.
[17] 张丽丽, 李洁, 陈长宝, 等. 三聚氰胺分子印迹表面等离子体共振传感器的制备及分析应用[J]. 分析化学, 2018, 46(1): 88-93.DOI:10.11895/j.issn.0253-3820.170003.
[18] 潘明飞, 李诗洁, 杨晶莹, 等. 抑制型表面等离子体共振免疫传感器再生循环检测花生中黄曲霉毒素B1[J]. 中国食品学报, 2018, 18(1):243-249. DOI:10.16429/j.1009-7848.2018.01.031.
[19] 王梓, 伍鹏, 朱芮, 等. 基于表面等离子共振的油品中类检测方法[J].纳米技术与精密工程, 2017, 15(6): 526-531. DOI:10.13494/j.npe.20160118.
[20] 夏敏, 罗进, 张经华, 等. 基于表面等离子体共振技术测定猪肉中磺胺类药物残留[J]. 食品科学, 2010, 31(6): 216-219.
[21] 廉双秋, 崔大付, 邓绍立. 利用表面等离子共振技术检测猪尿中盐酸克伦特罗[J]. 肉类研究, 2014, 28(11): 38-41.
[22] 邓绍立, 崔大付, 廉双秋. 利用表面等离子体共振生物传感器快速检测牛乳中的三聚氰胺[J]. 乳业科学与技术, 2015, 38(1): 18-21.DOI:10.7506/rykxyjs1671-5187-201501005.
[23] 张腾, 翟俊辉. 利用表面等离子共振法检测牛乳中的磺胺嘧啶[J].乳业科学与技术, 2017, 40(1): 13-15. DOI:10.15922/j.cnki.jdst.2017.01.003.
[24] 王春宇, 冯锋, 白云峰, 等. 基于表面等离子体共振技术用鸡蛋黄抗体IgY测定人血清中转铁蛋白[J]. 高等学校化学学报, 2012, 33(6):1177-1181. DOI:10.3969/j.issn.0251-0790.2012.06.011.
[25] MORITA K, KAWAGUCHI T. Highly selective and sensitivedetection of β-agonists using a surfaceplasmon resonance sensorbased on an alkanethiolmonolayerfunctionalized on a Au surface[J].Biosensors and Bioelectronics, 2015, 67(15): 356-363. DOI:10.1016/j.bios.2014.08.055.
[26] 李辉, 蔡浩原, 陈兴, 等. 表面等离子体共振生物传感器连续检测莱克多巴胺[J]. 分析化学, 2010, 38(3): 381-384. DOI:10.3724/SP.J.1096.2010.00381.
[27] SHANKARAN D R, GOBI K V, MIURA N. Recent advancementsin surface plasmon resonance immunosensors for detection of small molecules of biomedical, food and environmental interest[J].Sensorsand Actuators B: Chemical, 2007, 121(1): 158-177.DOI:10.1016/j.snb.2006.09.014.
[28] FARRÉ M, MARTÍNEZ E, RAMÓ J. Part per trillion determinationof atrazine in natural water samples by a surfaceplasmon resonanceimmunosensor[J]. Analytical and Bioanalytical Chemistry,2007, 388(1): 207-214. DOI:10.1007/s00216-007-1214-2.
[29] 罗进, 耿萌辉, 钱力, 等. 表面等离子体共振技术测定肉类食品中泰乐霉素和磺胺类药物残留量[J]. 理化检验(化学分册), 2011(4): 383-386.
[30] 宋洋, 王静, 王硕. 表面等离子体共振传感器对食源性化学危害物检测方法研究[J]. 中国食品学报, 2015, 15(7): 186-191.DOI:10.16429/j.1009-7848.2015.07.027.
Determination of Sulfamethazine in Pork Using a Surface Plasmon Resonance Biosensor
YU Jing1, FAN Sufang1,*, LI Qiang1, MA Junmei1, SHI Weijie1, MENG Zhijuan1, ZHANG Teng2, ZHANG Yan1,*
(1.Hebei Food Safety Key Laboratory, Hebei Food Inspection and Research Institute, Shijiazhuang 050091, China;2.Beijing Zhonglongyicheng Technology Co. Ltd., Beijing 100071, China)
Abstract:A new method was developed to determine sulfamethazine (SM2) in pork samples based on surface plasmon resonance (SPR). As a vector, nano-gold was used to connect SM2-bovine serum albumin conjugate to the surface of an SPR biosensor chip. Antigen and antibody concentrations were optimized, and optimal calibration curve was established.The recoveries of the method were in range of 87.6%-107.4% at spike levels of 10, 20 and 100 μg/kg, with relative standard deviations (RSDs) lower than 11%. This method was used to determine SM2 in real samples, and the results were confirmed by liquid chromatography-tandem mass spectrometry. Our data indicated that the method presented in this paper could be used for rapid screening and analysis of SM2 in pork samples.
Keywords:surface plasmon resonance; pork; sulfamethazine
YU Jing, FAN Sufang, LI Qiang, et al. Determination of sulfamethazine in pork using a surface plasmon resonance biosensor[J]. Meat Research, 2018, 32(10): 32-36. DOI:10.7506/rlyj1001-8123-201810006. http://www.rlyj.pub
俞婧, 范素芳, 李强, 等. 表面等离子体共振技术测定猪肉中磺胺二甲嘧啶[J]. 肉类研究, 2018, 32(10): 32-36.DOI:10.7506/rlyj1001-8123-201810006. http://www.rlyj.pub
引文格式:
文章编号:1001-8123(2018)10-0032-05
文献标志码:A
中图分类号:TS207.3
DOI:10.7506/rlyj1001-8123-201810006
*通信作者简介:范素芳(1985—),女,高级工程师,博士,研究方向为食品安全。E-mail:fansufang840502@163.com张岩(1979—),男,正高级工程师,博士,研究方向为食品安全。E-mail:snowwinglv@126.com
第一作者简介:俞婧(1977—),女,高级工程师,硕士,研究方向为食品安全。E-mail:yujing@nepp.com.cn
基金项目:国家重大科学仪器设备开发专项(2012YQ03011110)
收稿日期:2018-06-25