自然发酵肉制品中乳酸菌的筛选
云月英1,许 铭1,王文龙2,张艾艾1
(1.内蒙古科技大学生命科学与技术学院,内蒙古 包头 014010;2.内蒙古科技大学后勤处,内蒙古 包头 014010)
摘要:为获得适合肉制品发酵的优良乳酸菌菌株,对来源于自然发酵肉制品中的25 株乳酸菌进行筛选,其中19 株在6 g/100 mL NaCl和150 mg/kg NaNO2液体培养基中生长较好,结合其他发酵特性实验,13 株乳酸菌符合肉制品发酵剂标准,挑选其中3 株进行产酸能力、生长曲线及不同温度条件下生长情况的研究。结果表明:3 株菌均具有较强的增殖及产酸能力;培养12 h时菌株即进入稳定生长期,培养24 h时培养基pH值降到4左右;在肉制品的发酵温度范围内能较好地生长。经形态学和16S rRNA序列分析,3 株菌均为弯曲乳杆菌,它们均可作为潜在的开发肉制品发酵剂的出发菌株。
关键词:发酵肉制品;乳酸菌;分离纯化;筛选;鉴定
发酵肉制品是指在自然或人工控制条件下,利用微生物发酵作用生产的具有特殊风味、色泽和质地,且具有较长保存期的肉制品[1]。我国传统发酵肉制品虽然生产历史悠久、中外驰名,但其生产工艺多采用自然发酵方法,具有一定的不可靠性和不可控性。采用微生物定向接种发酵可以使发酵过程得到有效控制,产品的安全性和稳定性更有保证[2-3]。
乳酸菌是指一类能够将可发酵性糖类进行发酵降解、产生大量乳酸、呈革兰氏阳性、触酶阴性的球菌或杆菌的总称[4],它是最早从发酵肉制品中分离出来的微生物,在肉制品的自然发酵过程中发挥主要作用,能提高产品的感官品质、营养保健作用、安全性和贮藏性[5-8]。因此,筛选出具有优良性状的乳酸菌并将其应用到发酵肉制品的生产中是改善产品品质的主要途径,国内外学者对此做了大量研究[9]。如Bartkiene等[10]研究了3 株乳酸菌对冷薰猪肉香肠中多环芳烃、生物胺和腐败菌的影响,发现接种乳酸菌可以显著降低产品中苯并(a)芘和䓛的含量,其代谢产物对香肠中的致病菌和腐败菌有较好的抑制作用,且接种时间对生物胺的降解有显著影响。Kantachote等[11]以Pediococcus pentosaceusHN8和Lactobacillus namurensisNH2为混合发酵剂进行泰国发酵猪肉香肠的制备,结果表明,这2 株菌对香肠中生物胺和胆固醇含量的降低发挥了最大的作用。赵冰等[12]通过对产品感官、微生物、理化指标等的检测研究植物乳杆菌对羊肉风干香肠品质的影响,发现添加乳酸菌可以显著改善产品的感官和营养品质,并能够提高产品的安全性。
作为肉制品发酵剂的乳酸菌应能耐受6 g/100 mL NaCl和150 mg/kg NaNO2,在生产过程中还应具备发酵葡萄糖不产气、不产H2S、不产氨、不生成生物胺类物质、蛋白质及脂肪的分解能力低或无、产酸速度快、发酵碳水化合物产物主要为乳酸等特性,否则可能造成发酵肉制品的感官缺陷和质量安全隐患[2,13-15]。
本研究对自然发酵肉制品中的乳酸菌进行了分离、筛选以及部分生物学特性的研究,为发酵肉制品中乳酸菌资源的研究和利用以及肉制品乳酸菌发酵剂的开发提供科学依据。
1 材料与方法
1.1 材料与试剂
Axygen细菌基因组DNA小量制备试剂盒、TaqDNA聚合酶、DNA marker 上海桑尼生物科技有限公司。
1.2 仪器与设备
PSX智能型恒温恒湿培养箱 宁波莱福科技有限公司;SW-CJ-2 FD洁净工作台 上海博讯实业有限公司医疗设备厂;F 200显微镜 上海长方光学仪器厂;Td4Z离心机 江苏金檀荣华仪器制造有限公司;YXQ-LS-30SII立式压力灭菌器 上海东亚压力容器制造有限公司;JA5003电子分析天平 上海超平科技仪器有限公司;UV-7504单光束-可见分光光度计 上海欣茂仪器有限公司;2720 PCR仪 美国ABI公司;Tanon 2500凝胶成像系统 上海天能科技有限公司。
1.3 方法
1.3.1 乳酸菌的分离与纯化
在无菌条件下称取10 g自然发酵肉肠样品,加入90 mL无菌生理盐水,置于拍打式均质机内进行均质处理,取上清液接种于MRS液体培养基[16-17]中,于30 ℃条件下厌氧培养24 h。将培养液在MRS固体培养基(含质量浓度为30 g/L的CaCO3)上划线,挑取有溶钙圈的单个菌落,涂片、染色、镜检,同时进行触酶、运动性和乳酸的纸层析分析实验。将触酶实验阴性、无运动性、产乳酸的杆状、球状革兰氏阳性细菌进行纯化培养,并于-80 ℃保存[18-19]。
1.3.2 肉用乳酸菌的筛选
耐盐实验:将待测菌株接种于添加有质量浓度为0、2、4、6 g/100 mL NaCl的液体培养基中,30 ℃条件下培养24 h,于600 nm波长处测定光密度(optical delnsity,OD)值[20-21]。
耐亚硝酸盐实验:将待测菌株接种于添加有0、50、100、150 mg/kg NaNO2的液体培养基中,30 ℃条件下培养24 h,于600 nm波长处测定OD值[21]。
产黏实验:将待测菌株划线接种于产黏培养基中,30 ℃条件下培养24 h,挑取菌苔直接观察[14]。
产氨实验:将待测菌株接种于产氨培养基中,以不接种的空白培养基作为对照,37 ℃条件下培养24 h,在培养液中加入3~5 滴氨试剂,如果有黄色或棕红色沉淀产生,则为阳性[16]。
葡萄糖产气实验:将待测菌株接种于放有倒置杜氏小管的葡萄糖产气培养基中,30 ℃条件下培养24 h,观察是否产气,产气为阳性,不产气则为阴性[17]。
产H2S实验:将待测菌株接种于产H2S培养基中,30 ℃条件下培养24 h,培养基变黑为阳性,不变黑则为阴性[17]。
氨基酸脱羧酶实验:将待测菌株接种于添加和未添加氨基酸的氨基酸脱羧酶培养基中,37 ℃条件下恒温培养18~24 h,培养基呈紫色时为氨基酸脱羧酶实验阳性,呈黄色时为阴性[17]。
脂肪分解实验:取0.1 mL待测菌体培养液,均匀涂布于脂肪培养基上,30 ℃条件下倒置培养24 h,培养基出现红色斑点为阳性,不出现则为阴性[21]。
蛋白质分解实验:取0.1 mL待测菌体培养液,均匀涂布于蛋白质培养基上,30 ℃条件下倒置培养24 h,培养基出现蛋白质溶解圈为阳性,不出现则为阴性[21]。
生长曲线和产酸能力测定:将待测菌株接种于MRS液体培养基,30 ℃条件下培养24 h,以未接种的MRS液体培养基为空白对照,每2 h于600 nm波长处测定菌液的OD值和pH值[19,22]。
不同温度条件下菌株的生长情况:将待测菌株接种于MRS液体培养基,分别于10、20、30、40 ℃条件下连续培养24 h,以不接种的MRS液体培养基为空白对照,于600 nm波长处测定OD值[17,23]。
1.3.3 16S rRNA分子生物学鉴定
细菌基因组DNA的提取参照试剂盒说明书进行。以细菌基因组DNA为模版,用通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-CTACGGCTACCTTGTTACGA-3’)进行16S rRNA基因的聚合酶链式反应(polymerase chain reaction,PCR)扩增。
PCR反应体系(50 μL):基因组DNA 1 μL、引物27F和1492R各1.5 μL、Taq聚合酶(5 U/μL) 1 μL、10×Buffer(含2.5 mmol/L Mg2+)5 μL、dNTP(10 mmol/L)1 μL、重蒸水39 μL;PCR扩增条件:
95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,35 个循环,72 ℃延伸7 min。PCR产物经凝胶电泳分析后送派森诺生物科技股份有限公司(上海)测序,测序结果在NCBI基因库中进行BLAST同源性分析。
1.4 数据处理
使用Excel 2010软件进行数据处理与作图,用SPSS软件对数据进行差异性分析。
2 结果与分析
2.1 菌株的分离与纯化
从样品中共分离出36 株革兰氏阳性、触酶阴性、无运动性的菌株,菌落直径大多在1.5~2.5 mm之间,呈白色、光滑、整齐、凸起状态,多为链状杆菌,少数为球菌;经乳酸纸层析分析,25 株菌在纸层析中的Rf值与质量浓度为2 g/100 mL的乳酸接近。将革兰氏阳性、触酶阴性、产乳酸的25 株菌暂定为乳酸菌。
2.2 菌株的NaCl耐受性
表 1 乳酸菌的NaCl耐受性
Table 1 NaCl tolerance of different lactic acid bacteria

注:同行字母不同,表示差异显著(P<0.05);表中数值为菌株在相应培养基中培养24 h所得发酵液的OD600nm。表2同。
菌株编号NaCl质量浓度/(g/100 mL)0 2 4 6 M11.772±0.028a1.729±0.011b1.566±0.013c1.282±0.021dM21.629±0.002ab1.701±0.019a1.485±0.042b1.187±0.017cM31.800±0.015a1.681±0.048a1.478±0.039b1.120±0.019cM41.819±0.093a1.664±0.093a1.439±0.094b1.082±0.063cM51.710±0.033a1.668±0.036a1.466±0.060b1.212±0.025cM61.624±0.008a1.614±0.023a1.390±0.066b1.131±0.104cM71.730±0.045a1.659±0.032a1.464±0.069b1.187±0.047cM81.760±0.002a1.693±0.052a1.469±0.028b1.270±0.073cM91.758±0.030a1.677±0.085a1.505±0.048b1.260±0.031cM101.820±0.072a1.717±0.086ab1.625±0.033b1.445±0.017cM111.766±0.061a1.657±0.064b1.487±0.058c1.213±0.025dM121.656±0.090a1.553±0.017ab1.403±0.095b1.152±0.072cM131.258±0.021a1.076±0.044b0.841±0.027c0.366±0.017dM141.769±0.040a1.779±0.001a1.537±0.055b1.051±0.059cM151.775±0.056a1.762±0.071a1.617±0.025b1.198±0.072cM161.779±0.064a1.707±0.080a1.526±0.042b1.047±0.057cM171.902±0.004a1.809±0.015b1.597±0.032c1.253±0.036dM181.713±0.026a1.727±0.012a1.645±0.010a1.214±0.077bM191.727±0.062a1.751±0.074a1.637±0.083a1.184±0.067bM201.770±0.034a1.752±0.009a1.589±0.037b1.183±0.040cM211.509±0.019a1.504±0.035a1.569±0.043a1.418±0.039bM221.919±0.039a1.825±0.031b1.627±0.041c1.414±0.043dM231.837±0.086a1.721±0.007a1.556±0.059b1.283±0.071cM241.764±0.099a1.678±0.063ab1.539±0.069b1.544±0.045bM251.525±0.052a1.442±0.033b1.001±0.038c0.402±0.003d
在发酵肉制品中添加一定量的NaCl可赋予产品良好的感官和质构品质,并具有防腐保鲜的作用。在加工过程中,NaCl的添加量通常为2.5%~3.0%,随着发酵的进行,产品水分活度降低,NaCl含量会有不同程度的升高,所用乳酸菌发酵剂应能在质量浓度为6 g/100 mL的NaCl条件下生长[24-25]。
由表1可知,随着培养基中NaCl质量浓度的增加,菌株的生长能力总体呈下降趋势,当NaCl的质量浓度达到6 g/100 mL时,除菌株M1、M11、M13、M17、M22和M25外,其余19 株菌均表现出较强的耐受性,可作为下一步实验的出发菌株。
2.3 菌株的NaNO2耐受性
发酵肉制品在生产中为了达到发色、抑菌、抗氧化和增强风味等作用会添加适量的亚硝酸盐,同时肉制品在发酵过程中也会产生一定量的亚硝酸盐[26-27]。因此,作为肉用发酵剂的乳酸菌应对亚硝酸盐具有一定的耐受性。
表 2 筛选菌株的NaNO2耐受性
Table 2 NaNO2tolerance of selected strains
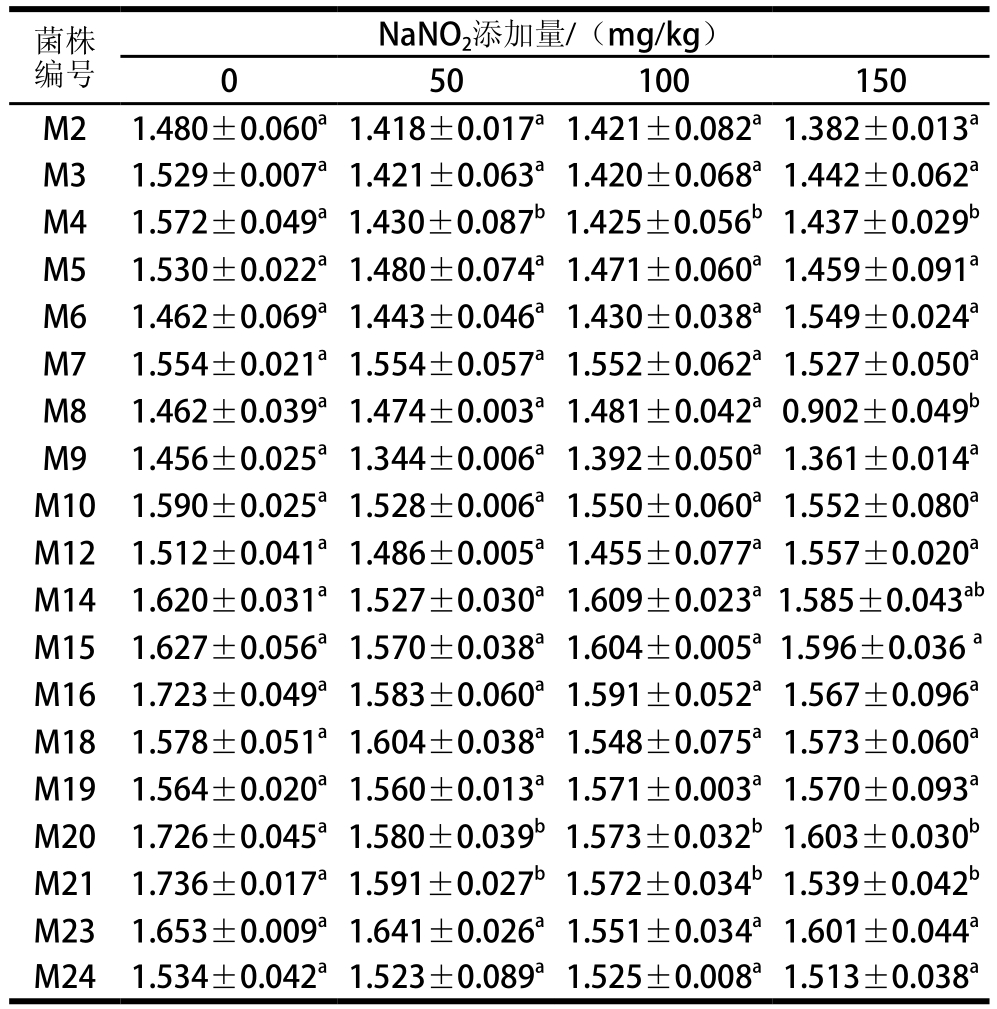
菌株编号NaNO2添加量/(mg/kg)0 50100150 M21.480±0.060a1.418±0.017a1.421±0.082a1.382±0.013aM31.529±0.007a1.421±0.063a1.420±0.068a1.442±0.062aM41.572±0.049a1.430±0.087b1.425±0.056b1.437±0.029bM51.530±0.022a1.480±0.074a1.471±0.060a1.459±0.091aM61.462±0.069a1.443±0.046a1.430±0.038a1.549±0.024aM71.554±0.021a1.554±0.057a1.552±0.062a1.527±0.050aM81.462±0.039a1.474±0.003a1.481±0.042a0.902±0.049bM91.456±0.025a1.344±0.006a1.392±0.050a1.361±0.014aM101.590±0.025a1.528±0.006a1.550±0.060a1.552±0.080aM121.512±0.041a1.486±0.005a1.455±0.077a1.557±0.020aM141.620±0.031a1.527±0.030a1.609±0.023a1.585±0.043abM151.627±0.056a1.570±0.038a1.604±0.005a1.596±0.036aM161.723±0.049a1.583±0.060a1.591±0.052a1.567±0.096aM181.578±0.051a1.604±0.038a1.548±0.075a1.573±0.060aM191.564±0.020a1.560±0.013a1.571±0.003a1.570±0.093aM201.726±0.045a1.580±0.039b1.573±0.032b1.603±0.030bM211.736±0.017a1.591±0.027b1.572±0.034b1.539±0.042bM231.653±0.009a1.641±0.026a1.551±0.034a1.601±0.044aM241.534±0.042a1.523±0.089a1.525±0.008a1.513±0.038a
由表2可知,NaNO2的添加对受试菌株生长的抑制作用不明显,当NaNO2的添加量增加到150 mg/kg时,19 株菌仍具有较强的耐受能力。
2.4 菌株的主要发酵特性
由表3可知,筛选出的19 株菌中有3 株产黏液,2 株发酵葡萄糖产气,2 株产H2S,所有菌株均不产氨、不具有氨基酸脱羧酶活性、不具有脂肪及蛋白质分解能力。除菌株M2、M3、M4、M10、M19、M20外,其余菌株均符合肉用乳酸菌发酵剂的基本要求,挑选其中3 株菌(M18、M21、M24),对其产酸能力、生长曲线、不同温度条件下的生长情况进行进一步研究。
表 3 筛选菌株的主要发酵特性
Table 3 Fermentation characteristics of selected strains

注:+. 阳性;-. 阴性。
菌株编号产黏液产氨发酵葡萄糖产气产H2S氨基酸脱羧酶活性分解脂肪分解蛋白质M2+------M3+--+---M4+------M5-------M6-------M7-------M8-------M9-------M10---+---M12-------M14-------M15-------M16-------M18-------M19--+----M20--+----M21-------M23-------M24-------
2.5 菌株的产酸能力
李凤彩等[28]的研究表明,pH值的降低速度对发酵食品的安全性有重要影响。测定菌株M18、M21、M24在24 h培养过程中培养基的pH值,并绘制曲线。
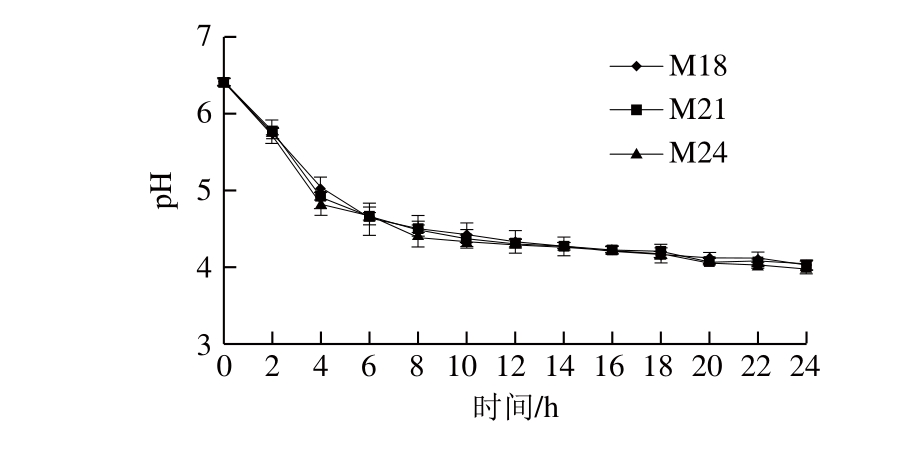
图 1 筛选菌株培养基24 h内的pH值变化
Fig. 1 Change in medium pH with selected strains during 24 hours of culture
由图1可知,3 株菌的pH值变化趋势一致,在培养初期,培养基的pH值迅速下降,培养6 h后,pH值由最初的6.4下降到4.6左右,之后下降速率减缓,pH值趋于稳定,这主要与培养初期菌体增殖速度快、代谢产生大量乳酸有关。培养24 h时,培养基的pH值接近4,表明这3 株菌具有较快和较强的产酸能力。因此,这3 株乳酸菌均符合肉制品发酵剂的产酸要求。

图 2 筛选菌株的生长曲线
Fig. 2 Growth curves of selected strains
2.6 菌株的生长曲线用作肉制品发酵剂的乳酸菌要求具有较强的增殖能力。由图2可知,3 株菌生长曲线的总体趋势相似,适应环境能力较强,延滞期相对较短,在0~12 h内迅速生长繁殖,菌体浓度显著增加,12 h以后各菌株的生长曲线平缓,进入稳定生长期。
2.7 菌株在不同温度条件下的生长情况
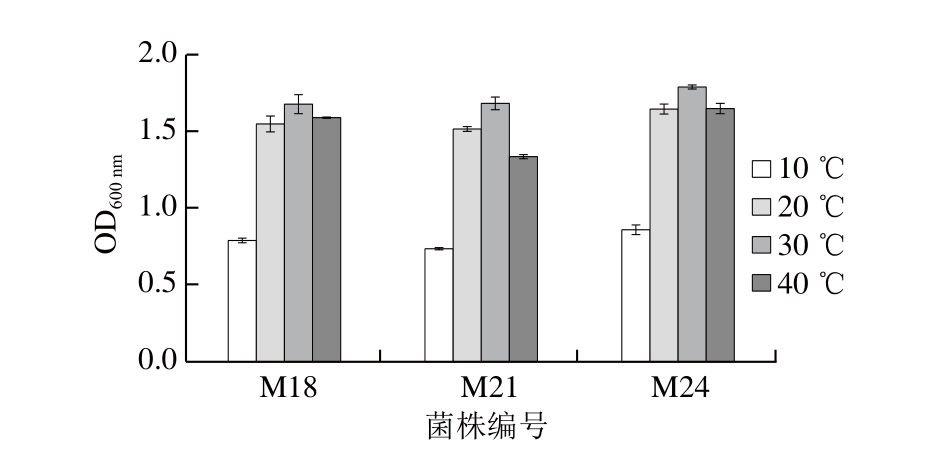
图 3 筛选菌株在不同温度下的生长情况
Fig. 3 Effect of temperature on the growth of selected strains
由图3可知,3 株菌均能在10~40 ℃条件下生长,20~40 ℃时生长较好,30 ℃时菌体浓度达到最大值。这与肉制品发酵剂对乳酸菌的要求(15~40 ℃条件下能够生长,低温下生长能力强,最适生长温度为30~37 ℃)相符[2]。
2.8 菌株16S rRNA序列分析

图 4 筛选菌株16S rRNA的PCR产物电泳图
Fig. 4 Electrophoresis of PCR amplified 16S rRNA genes from selected strains
由图4可知,对菌株M18、M21、M24的PCR产物进行电泳分析,得到大小约为1 500 bp的特异性扩增产物,测序片段长度分别为1 500、1 479、1 497 bp,符合16S rRNA序列长度。将获得的序列在NCBI上进行BLAST同源性分析,发现这3 株菌与弯曲乳杆菌(Lactobacillus curvatus)有99%的同源性。当16S rRNA序列同源性高于97%时,可以认为是属内的同种[29-30],因此确定M18、M21、M24为弯曲乳杆菌。
3 结 论
本研究对自然发酵肉制品中的乳酸菌进行了分离、筛选并对其部分生物学特性进行了研究。经分离、纯化共得到25 株乳酸菌,其中19 株菌对质量浓度为6 g/100 mL的NaCl和150 mg/kg的NaNO2具有较强的耐受性,除菌株M2、M3、M4产黏液,M19、M20发酵葡萄糖产气,M3、M10产H2S外,其余13 株菌均符合肉用乳酸菌发酵剂的基本要求。挑选其中3 株菌(M18、M21、M24),对其产酸能力、生长曲线及在不同温度条件下的生长情况进行研究,结果表明,3 株菌均具有较强的增殖能力及产酸能力,培养12 h时即进入稳定生长期,培养24 h时培养基pH值达到4左右,在肉制品的发酵温度范围内能较好地生长。经形态学和16S rRNA序列分析,确定此3 株菌均为弯曲乳杆菌,它们可以作为潜在的开发肉制品发酵剂的出发菌株。
参考文献:
[1] 孔保华, 韩建春. 肉品科学与技术[M]. 2版. 北京: 中国轻工业出版社, 2003: 307.
[2] 张春晖. 发酵肉制品加工技术[M]. 北京: 中国农业出版社, 2014:5-6; 46-49.
[3] 龙强, 聂乾忠, 刘成国. 发酵肉制品功能性发酵剂研究现状[J].食品科学, 2016, 37(17): 263-269. DOI:10.7506/spkx1002-6630-201617044.
[4] 张刚. 乳酸细菌: 基础、技术和应用[M]. 北京: 化学工业出版社, 2007: 11.
[5] KOŁOŻYN-KRAJEWSKA D, DOLATOWSKI Z J. Probiotic meat products and human nutrition[J]. Process Biochemistry, 2012, 47(12):1761-1772. DOI:10.1016/j.procbio.2012.09.017.
[6] MAKSIMOVIĆ ☒ A, HULAK N, VUKO M, et al. Lactic acid bacteria in traditional dry sausage production[J]. Scientific and Professional Section, 2015, 17(6): 575-580.
[7] DOM☒NGUEZ R, AGREG☒N R, LORENZO J M. Role of commercial starter cultures on microbiological, physicochemical characteristics, volatile compounds and sensory properties of dry-cured foal sausage[J]. Asian Pacific Journal of Tropical Disease, 2016, 6(5): 396-403. DOI:10.1016/S2222-1808(15)61055-6.
[8] LIU Shanna, HAN Ye, ZHOU Zhijiang. Lactic acid bacteria in traditional fermented Chinese foods[J]. Food Research International, 2011, 44(3): 643-651. DOI:10.1016/j.foodres.2010.12.034.
[9] 杜莎, 谭雅, 谢佳琦, 等. 发酵肉制品品质改善途径的研究进展[J]. 食品工业科技, 2016, 37(16): 374-378. DOI:10.13386/ j.issn1002-0306.2016.16.066.
[10] BARTKIENE E, BARTKEVICS V, MOZURIENE E, et al. The impact of lactic acid bacteria with antimicrobial properties on biodegradation of polycyclic aromatic hydrocarbons and biogenic amines in cold smoked pork sausages[J]. Food Control, 2017, 71:285-292. DOI:10.1016/j.foodcont.2016.07.010.
[11] KANTACHOTE D, RATANABUREE A, SUKHOOM A, et al. Use ofγ-aminobutyric acid producing lactic acid bacteria as starters to reduce biogenic amines and cholesterol in Thai fermented pork sausage (Nham) and their distribution during fermentation[J]. LWTFood Science and Technology, 2016, 70: 171-177. DOI:10.1016/ j.lwt.2016.02.041.
[12] 赵冰, 李素, 成晓瑜, 等. 乳酸菌对羊肉风干香肠的影响[J]. 食品科学, 2015, 36(5): 109-114. DOI: 10.7506/spkx1002-6630-201505021.
[13] AMMOR M S, MAYO B. Selection criteria for lactic acid bacteria to be used as functional starter cultures in dry sausage production:an update[J]. Meat Science, 2007, 76(1): 138-146. DOI:10.1016/ j.meatsci.2006.10.022.
[14] 崔廷婷, 王洋, 戴瑞彤, 等. 肉用乳酸菌发酵剂菌株的分离筛选与鉴定[J]. 食品与生物技术学报, 2011, 30(2): 239-244.
[15] 蔡鲁峰, 杜莎, 谭雅, 等. 乳酸菌肉品发酵剂的发酵特性研究[J]. 食品工业科技, 2015, 36(17): 150-155. DOI:10.13386/ j.issn1002-0306.2015.17.022.
[16] 郭兴华, 凌代文. 乳酸细菌现代研究实验技术[[M]. 北京: 科学出版社, 2013: 80-98.
[17] 卢士玲, 吴桂春, 李开雄. 发酵肉制品中乳酸菌的分离、筛选和鉴定[J]. 食品与生物技术学报, 2006, 25(3): 116-121.
[18] 帅瑾. 传统自然发酵四川香肠中乳酸菌的分离、鉴定及其应用[D].雅安: 四川农业大学, 2013: 12.
[19] 黄丹, 刘有晴, 于华, 等. 四川传统发酵肉中乳酸菌的分离及发酵特性研究[J]. 食品工业科技, 2016, 37(3): 149-152; 159. DOI:10.13386/ j.issn1002-0306.2016.03.023.
[20] 娄利娇, 胡萍, 湛剑龙, 等. 分离自贵州侗族苗族发酵肉中两株乳酸菌的耐受特性分析[J]. 中国酿造, 2015, 34(11): 126-130. DOI:10.11882/j.issn.0254-5071.2015.11.029.
[21] 吴晓萌, 郭雪松. 几株应用于发酵肉制品的乳酸菌的筛选[J]. 肉类工业, 2013(7): 37-41.
[22] 牛天贵. 食品微生物学实验技术[M]. 北京: 中国农业大学出版社, 2011: 140-141.
[23] 段艳, 靳烨, 靳志敏, 等. 分离自内蒙古传统肉肠乳酸菌的生长及产酸能力研究[J]. 食品工业科技, 2012, 33(10): 206-211. DOI:10.13386/j.issn1002-0306.2012.10.071.
[24] 马德功, 王成忠, 崔文文, 等. 发酵香肠乳酸菌发酵剂筛选标准[J].肉类研究, 2007, 21(12): 31-33.
[25] 张平. 食盐用量对四川腊肉加工及贮藏过程中品质变化的影响[D].成都: 四川农业大学, 2014: 8.
[26] 刘丽莉, 杨协力. 发酵肉制品中乳酸菌菌种筛选研究[J]. 农业机械学报, 2006, 37(8): 229-231.
[27] 张红涛, 孔保华, 蒋亚男. 肉制品中亚硝酸盐替代物的研究进展及应用[J]. 包装与食品机械, 2012, 30(3): 50-54. DOI:10.39/ j.issn.1005-1295.2012.03.013.
[28] 李凤彩, 程文新, 谢华, 等. 发酵香肠菌种筛选标准探讨[J]. 食品科技, 2002, 23(6): 78-79. DOI:10.13386/j.issn1002-0306.2002.06.032.
[29] VANDAMME P, POT B, GILIS M, et al. Polyphase taxonomy, a consensus approach to bacterial systematics[J]. Microbiological Reviews, 1996, 60(2): 407-438.
[30] WEI Guifang, PAN Li, DU Huimin, et al. ERIC-PCR fingerprinting based community DNA hybridization to pinpoint genome specific ragments as molecular markers to identify and track populations common to healthy human guts[J]. Journal of Microbiological Methods, 2004, 59(1): 91-108. DOI:10.1016/j.mimet.2004.06.007.
Screening of Lactic Acid Bacteria from Naturally Fermented Meat Products
YUN Yueying1, XU Ming1, WANG Wenlong2, ZHANG Aiai1
(1. School of Life Science and Technology, Inner Mongolia University of Science and Technology, Baotou 014010, China; 2. Department of Logisitics Management, Inner Mongolia University of Science and Technology, Baotou 014010, China)
Abstract:A total of 25 strains of lactic acid bacteria were isolated and purified from naturally fermented meat products, and they were screened for their potential to be used as starter cultures for fermented meat products. Out of these, 19 strains could grow well in the presence of 6 g/100 mL NaCl and 150 mg/kg NaNO2, and 13 strains were suitable to be used as starter cultures for fermented meat products based on their fermentation characteristics, out of which three were then selected for evaluation of their acid production ability, growth curves and growth performance at different temperatures. The results showed that all three isolates had strong proliferation ability and acid production ability, which entered the stationary phase after 12 h of culture. The pH of the medium was reduced to around 4 after 24 h of culture. Moreover, they grew well in fermented meat products. By morphological and 16S rRNA sequence analysis, all these strains were identified asLactobacillus curvatus, and they had the potential to be used as starter cultures for fermented meat products.
Key words:fermented meat products; lactic acid bacteria; separation and purification; screening; identification
DOI:10.7506/rlyj1001-8123-201706004
中图分类号:TS201.3
文献标志码:A
文章编号:1001-8123(2017)06-0019-05
引文格式:
云月英, 许铭, 王文龙, 等. 自然发酵肉制品中乳酸菌的筛选[J]. 肉类研究, 2017, 31(6): 19-23. DOI:10.7506/rlyj1001-8123-201706004. http://www.rlyj.pub
YUN Yueying, XU Ming, WANG Wenlong, et al. Screening of lactic acid bacteria from naturally fermented meat productsJ]. Meat Research, 2017, 31(6): 19-23.
DOI:10.7506/rlyj1001-8123-201706004. http://www.rlyj.pub
收稿日期:2017-01-13
基金项目:内蒙古自治区自然科学基金项目(2015MS0333)
作者简介:云月英(1980—),女,讲师,硕士,研究方向为食品微生物。E-mail:yunyueying1999@163.com






