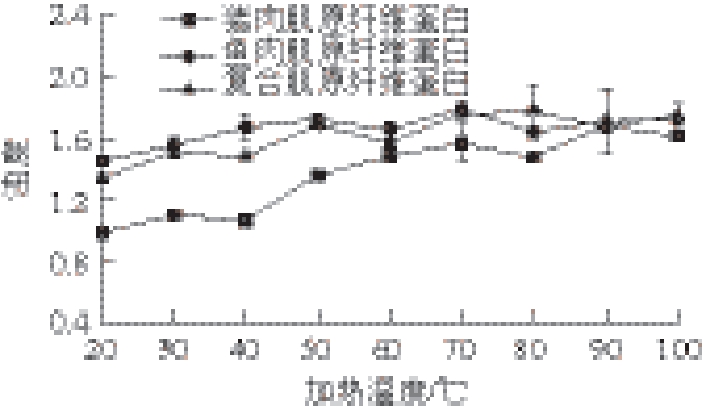
图 1 温度对复合肌原纤维蛋白浊度的影响
Fig. 1 Effects of temperature on turbidity of mixed myofibrillar proteins
李清正 1,张顺亮 2,罗永康 1,冯力更 1,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.中国肉类食品综合研究中心,北京 100068)
摘 要:温度是影响蛋白质结构和功能变化的主要因素。实验研究猪肉肌原纤维蛋白、鲢鱼肉肌原纤维蛋白、复合肌原纤维蛋白(猪肉、鲢鱼肉肌原纤维蛋白质量比1∶1),在不同温度下二级结构、构象、浊度、表面疏水性的变化,并对其结构和表面疏水性变化规律的差别与相关性进行研究。结果表明:随着温度的升高,猪肉、鲢鱼肉和复合肌原纤维蛋白的浊度都会升高;α-螺旋和无规则卷曲含量降低至稳定,β-折叠含量升高至稳定;蛋白质构象发生变化趋向稳定以适应新环境;表面疏水性升高后在高温下轻微下降至稳定,蛋白质逐渐趋向完全变性。复合肌原纤维蛋白的热变性规律与单一蛋白不完全相同,能够结合猪肉、鲢鱼肉肌原纤维蛋白的优点,改善肌原纤维蛋白随温度变化的性质。
关键词:肌原纤维蛋白;猪肉;鲢鱼;复合;温度;结构;表面疏水性
肌原纤维蛋白是肌肉中主要的蛋白质之一,又称盐溶蛋白,由肌动蛋白、肌球蛋白、肌钙蛋白等组成,占肌肉总蛋白含量的50%~55%。肌原纤维蛋白具有良好的凝胶能力 [1],其凝胶性能的变化影响着肉制品的品质,因此肌原纤维蛋白在肉制品,尤其是糜类肉制品加工中发挥着重要作用。
温度是影响蛋白质结构和功能特性的主要因素。随着温度升高,蛋白质结构逐渐变化,蛋白质分子发生变性、分解或聚集,从而导致蛋白质的水合特性、凝胶特性、分子间相互作用等功能特性发生改变。此外,不同加热方式对蛋白质结构和功能特性的影响也有差别 [2-5]。蛋白质的热变性对肌肉品质有很大影响,能够改变肌肉的持水性能、色泽、质构等。孔保华等 [6]研究发现,猪肉肌原纤维蛋白在70~80 ℃之间保水性最好;Lin等 [7]指出,新鲜草鱼经热处理后,硬度、弹性和咀嚼性等都会优于生鲜草鱼;赵冰等 [8]发现,100 ℃的中温杀菌温度能够很好地保持乳化香肠的质构特性;姜启兴 [9]指出,鳙鱼肌原纤维蛋白中α-螺旋结构随着温度升高逐渐转变为β-折叠、β-转角和无规则卷曲,硬度、咀嚼性呈现先增后降的趋势。
近年来,有关复合蛋白凝胶、复合鱼糜的研究逐渐增多。刘蕾等 [10]研究发现,凝胶化温度为30 ℃,鲢鱼和带鱼鱼糜比例为7∶3时,复合鱼糜凝胶强度高于鲢鱼鱼糜和带鱼鱼糜;刘蕾等 [11]还发现小黄鱼和鲢鱼肌原纤维蛋白1∶1复合后的变化规律与小黄鱼相似,而不同于鲢鱼;王卫芳 [12]则推测鱼肉和猪肉肌原纤维蛋白复合后经加热可形成一种复合凝胶,蛋白质之间发生了相互作用。但关于温度对复合肌原纤维蛋白结构和表面疏水性影响及其关系的研究却很少,因此有必要对此开展相应研究。
本实验通过研究温度对复合肌原纤维蛋白二级结构、构象和表面疏水性的影响,对比分析了复合肌原纤维蛋白和单一肌原纤维蛋白在热加工中结构、表面疏水性的变化规律。这将为复合肉制品和中温肉制品的开发提供理论依据,同时也为肉制品品质控制和加工工艺优化提供参考。
1.1 材料与试剂
猪肉(后腿精瘦肉)购自北京美廉美超市学院路店;鲢鱼购自北京健翔桥农贸市场,活运至实验室。
所有试剂均为分析纯 北京化学试剂公司。
1.2 仪器与设备
FW 2000分散均质机 上海弗鲁克公司;GL-21M超速冷冻离心机 长沙平凡仪器仪表公司;FE20酸度计 梅特勒-托利多(上海)仪器有限公司;WZ-100SP水浴锅 上海申生科技有限公司;UV-2600分光光度计上海优尼科仪器公司;F97PRO荧光分光光度计 上海棱光技术有限公司;Pistar π-180远紫外圆二色谱仪 英国Applied Photophysics公司。
1.3 方法
1.3.1 预处理
猪肉剔去脂肪和结缔组织,切碎后备用。鲢鱼击晕后立即去鳞和内脏,流动水冲洗干净,沥干后取背部白肉备用。
1.3.2 肌原纤维蛋白的提取
参考姜启兴 [9]的方法,略作改动。取5 g肉,加入20 mL pH7.0的50 mmol/L磷酸缓冲液(含0.1 mol/L NaCl、1 mmol/L乙二胺四乙酸、2 mmol/L MgCl 2),均质后于4℃、8 000 r/min离心15 min,倾去上清液,沉淀重复上述步骤1次。所得沉淀加入20 mL冷的0.1 mol/L NaCl溶液,4℃、8 000 r/min离心15 min,倾去上清液,沉淀重复洗涤1次。最后所得沉淀即为肌原纤维蛋白。
1.3.3 蛋白质浓度的测定
参照杨建雄 [13]的方法,采用双缩脲法测定。
1.3.4 肌原纤维蛋白加热处理
将所得肌原纤维蛋白沉淀用0.6 mol/L KCl溶液调至所需质量浓度,分别置于30、40、50、60、70、80、90、100 ℃水浴中加热10 min,结束后立即放入冰水浴中降温备用。对照组不经加热处理(20 ℃)。
1.3.5 浊度的测定
调整蛋白质量浓度为2 mg/mL,加热后于350 nm波长处测定吸光度,以0.6 mol/L KCl做空白。
1.3.6 蛋白质二级结构的测定
参考Zhang等 [14]的方法略作修改,采用圆二色谱法测定。将肌原纤维蛋白用0.4 mol/L NaCl溶液稀释至质量浓度为0.2 mg/mL,以0.4 mol/L NaCl溶液作为空白扫描,扫描范围190~260 nm,比色皿长度0.1 cm。二级结构含量使用Dichroweb分析,在线网址http://dichroweb.cryst.bbk. ac.uk [15]。
1.3.7 蛋白质构象变化的测定
采用荧光光度法。将肌原纤维蛋白用0.6 mol/L KCl溶液稀释至质量浓度为0.05 mg/mL,激发波长295 nm,激发和发射狭缝宽度均为2.5 nm,波长扫描范围310~400 nm,扫描速率3 000 nm/min。
1.3.8 表面疏水性的测定
以1-苯奈氨-8-磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)作为荧光探针,用pH 7.0的0.6 mol/L NaCl-10 mmol/L磷酸盐缓冲液将肌原纤维蛋白质量浓度分别调至0.2、0.3、0.5、1.0 mg/mL。4种质量浓度的蛋白溶液各取2 mL,加入10 μL pH 7.0含8 mmol/L ANS的0.1 mol/L磷酸盐缓冲液,混匀后用荧光分光光度计测定,条件为:激发波长和发射波长分别为390 nm和470(468) nm,λ EX和λ EM缝宽均为5 nm。用荧光强度对蛋白质浓度的斜率表示蛋白质表面疏水性。
1.4 数据处理
实验数据处理采用Excel 2007,作图采用Origin 8.5,显著性分析采用SPSS 21。
2.1 温度对复合肌原纤维蛋白浊度的影响

图 1 温度对复合肌原纤维蛋白浊度的影响
Fig. 1 Effects of temperature on turbidity of mixed myofibrillar proteins
由图1可知,随着温度升高,猪肉、鱼肉、复合肌原纤维蛋白浊度都显著增加(P<0.05),蛋白质逐渐交联、聚集、沉淀,变性程度加剧。复合蛋白浊度变化与鱼肉无明显差异(P>0.05),与猪肉显著不同(P<0.05)。根据刘茹 [16]的报道,鲢鱼肉肌球蛋白和肌动蛋白的变性峰分别为44.7 ℃和71.7 ℃,猪肉蛋白质的变性峰分别是59.7 ℃和76.8 ℃,浊度变化率变化点基本出现在蛋白变性温度附近,在50℃之后,3 种蛋白浊度的变化程度逐渐减小,60~70 ℃后浊度基本趋同,肌原纤维蛋白趋向完全变性。2.2 温度对复合肌原纤维蛋白二级结构的影响
天然蛋白质中不同的二级结构在圆二色谱中会表现出不同的特征吸收 [17]:α-螺旋在190 nm波长处有1 个正峰,在204 nm和221 nm波长处有2 个负峰;β-折叠在195 nm有正峰,在215~217 nm出现负峰;β-转角在180~190 nm会出现负峰;无规则卷曲在小于200 nm波长处会出现单负峰,在218 nm附近则有较弱谱带。
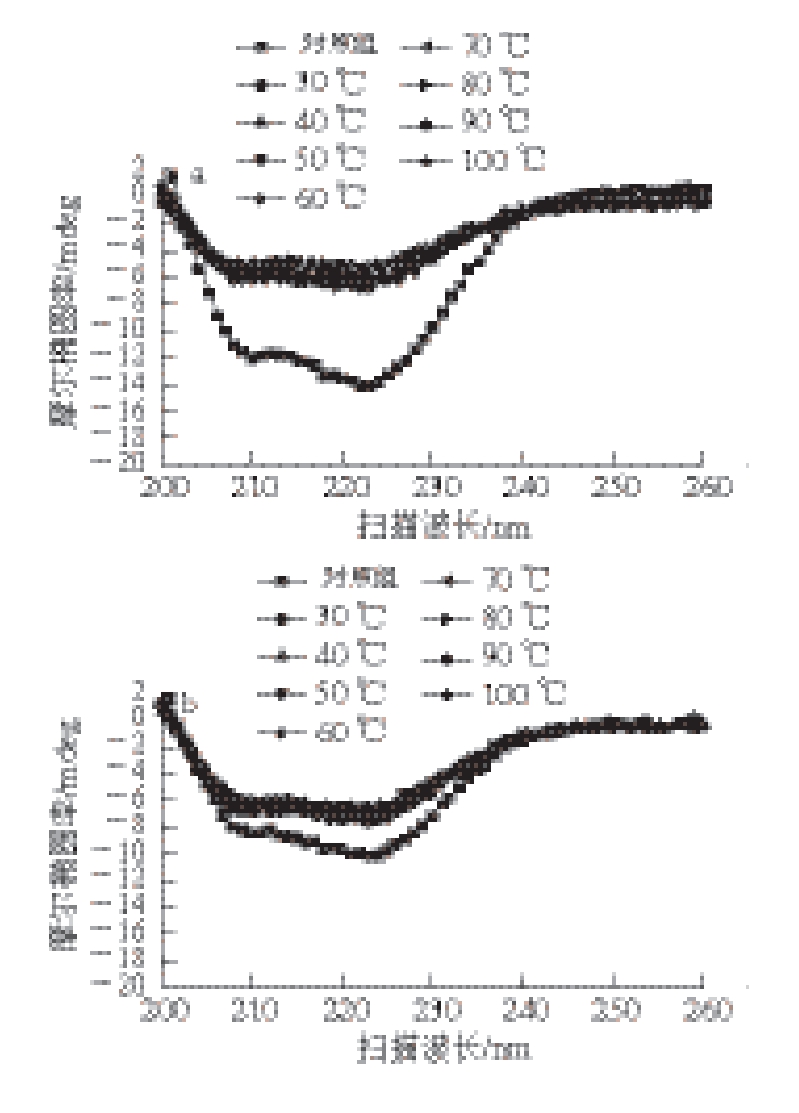
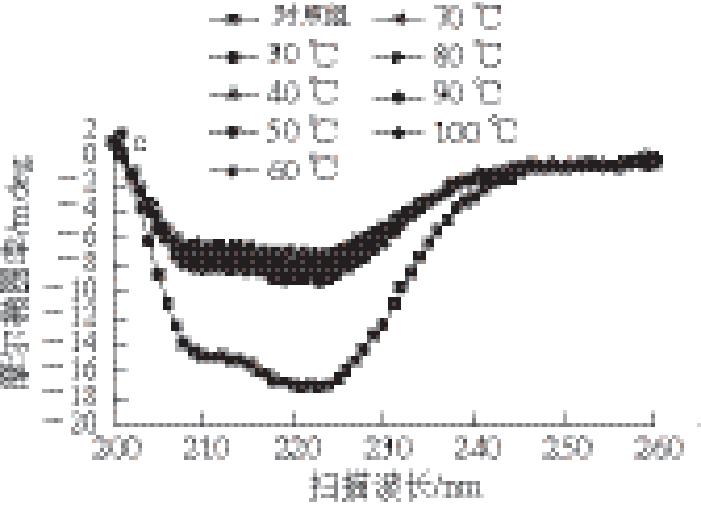
图 2 复合肌原纤维蛋白在不同温度下的圆二色谱图
Fig. 2 Circular dichroism spectrum of mixed proteins at different temperatures
a. 猪肉肌原纤维蛋白;b. 鱼肉肌原纤维蛋白;c. 复合肌原纤维蛋白(猪肉、鱼肉质量比为1∶1)。下同。
由图2可知,3 种肌原纤维蛋白在204 nm和221 nm附近均有2 个负峰,对照组2 个负峰非常明显,说明未加热的肌原纤维蛋白中含有较多的α-螺旋结构。随着温度升高,2 个负峰逐渐变弱,尤其在温度升高到30~40 ℃时,负峰明显减弱,表明α-螺旋含量明显下降。3 种肌原纤维蛋白二级结构含量变化如表1所示。
表 1 不同肌原纤维蛋白在不同温度下二级结构的变化
Table 1 Changes in secondary structures of different myofibrillar proteins at different temperatures
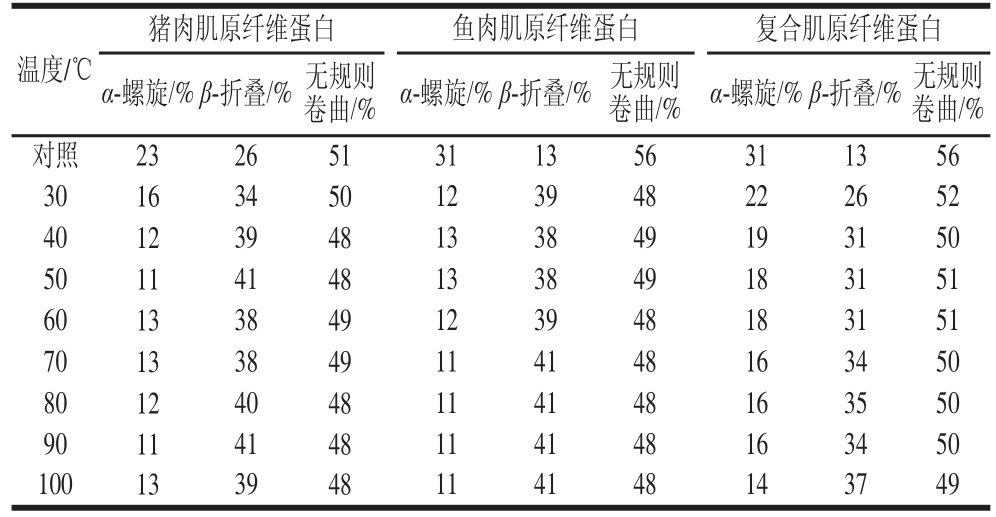
温度/℃猪肉肌原纤维蛋白鱼肉肌原纤维蛋白 复合肌原纤维蛋白α-螺旋/%β-折叠/%无规则卷曲/%α-螺旋/%β-折叠/%无规则卷曲/%α-螺旋/%β-折叠/%无规则卷曲/%对照232651311356311356 30163450123948222652 40123948133849193150 50114148133849183151 60133849123948183151 70133849114148163450 80124048114148163550 90114148114148163450 100133948114148143749
由表1可知,猪肉肌原纤维蛋白的α-螺旋和无规则卷曲含量随温度升高而下降,β-折叠含量则上升,在40 ℃后基本稳定;随温度升高,鱼肉肌原纤维蛋白的α-螺旋和无规则卷曲含量下降,β-折叠含量上升,但在30 ℃后即达到稳定。这说明猪肉肌原纤维蛋白比鱼肉肌原纤维蛋白拥有更高的热稳定性。刘茹 [16]的研究也证实了猪肉蛋白具有更高的变性温度,因而具有更好的热稳定性;Wu等 [18]和Arai等 [19]也曾报道鱼肉蛋白的热稳定性低于哺乳动物蛋白。
复合肌原纤维蛋白初始时的二级结构含量与鱼肉肌原纤维蛋白相近。随着温度升高,α-螺旋和无规则卷曲含量下降,β-折叠含量上升,在40 ℃后达到稳定,这与猪肉肌原纤维蛋白的变化趋势无明显差别(P>0.05),表明复合肌原纤维蛋白能够结合猪肉和鱼肉肌原纤维蛋白的特点,热稳定性有所改善。同时,复合肌原纤维蛋白稳定后的α-螺旋和无规则卷曲含量要高于单一肌原纤维蛋白,β-折叠含量则较低,这表明猪肉和鱼肉肌原纤维蛋白之间可能发生了相互作用,对蛋白质二级结构的含量产生了影响,因而与单一蛋白性质产生差异。Bouraoui等 [20]曾报道鱼肉和猪肉蛋白能够发生相互作用形成更多的无规则卷曲结构;蛋白质二级结构的变化也将对蛋白质功能特性产生影响,尤其是β-折叠含量的变化,会对蛋白质表面疏水性产生很大影响 [21]。
2.3 温度对复合肌原纤维蛋白构象的影响
蛋白质中含有的芳香族氨基酸残基侧链基团具有吸收紫外入射光而发射荧光的特性,可利用此特点来研究变性过程中蛋白质的空间构象变化。色氨酸摩尔消光系数高,对周围微环境敏感 [22],是最常用的内源荧光探针。随着蛋白质的变性,色氨酸侧链基团逐渐暴露在水溶液中,其所处环境的极性变大,蛋白质荧光发射峰λ max增大,发生红移 [23]。红移程度越大,变性过程中蛋白质构象变化程度越大。此外,荧光强度会随着色氨酸从内部疏水区向外暴露而增大,能够表征蛋白质构象的变化程度 [24]。3 种肌原纤维蛋白在不同温度下的构象变化如图3所示。
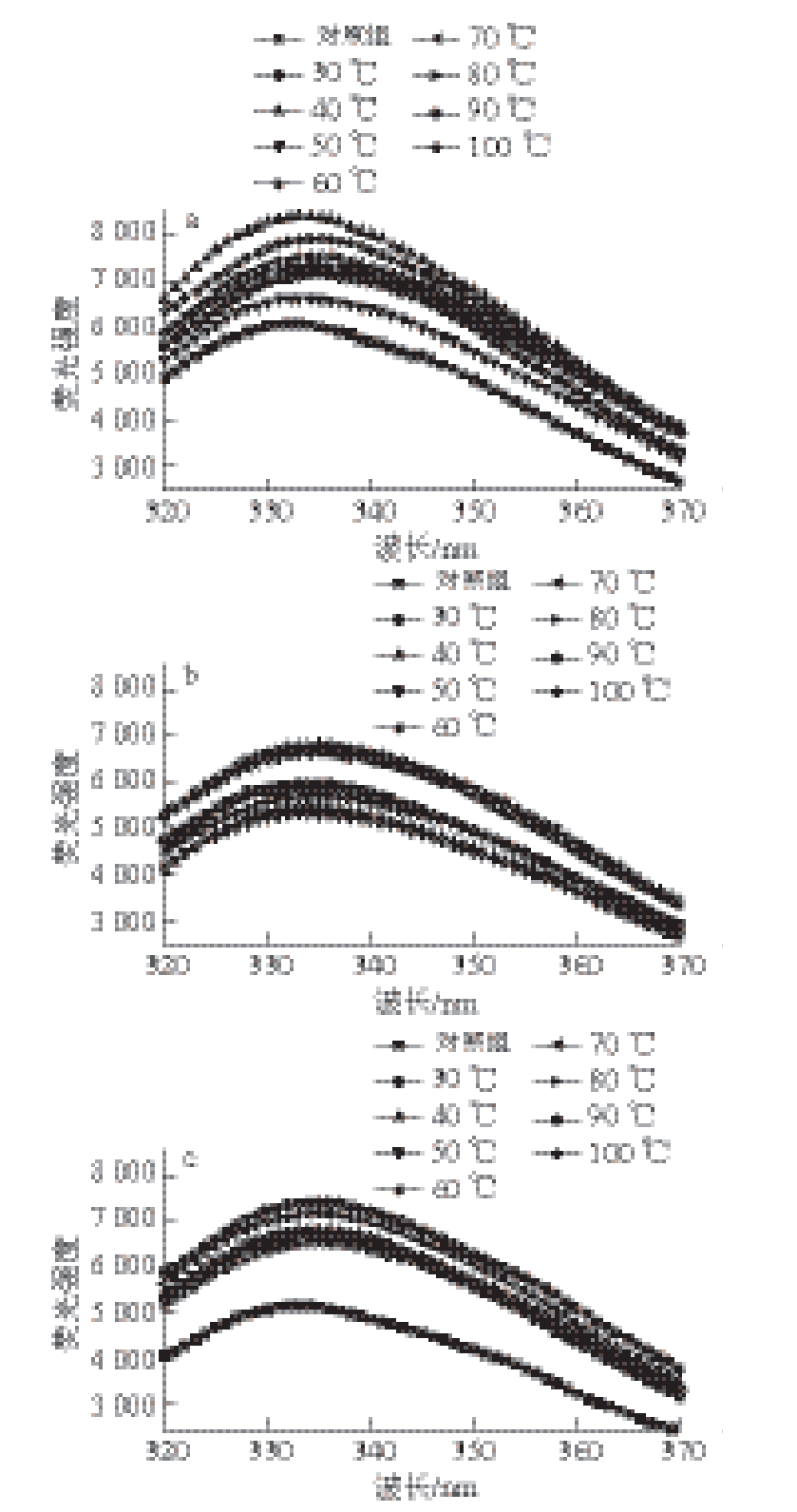
图 3 温度对复合肌原纤维蛋白构象的影响
Fig. 3 Effects of temperature on conformation of mixed myofibrillar proteins
由图3a可知,猪肉肌原纤维蛋白λ max从332 nm红移至335 nm,荧光强度先增大后减小至稳定,在40 ℃达到最大,70 ℃后基本稳定。这表明随着温度的升高,猪肉肌原纤维蛋白内部色氨酸侧链基团逐渐暴露,蛋白构象发生改变,蛋白变性程度增加,但在达到一定温度后,蛋白质会趋向完全变性,构象逐渐趋向较为稳定的变性状态以适应环境变化 [25]。由图3b可知,鱼肉肌原纤维蛋白随着加热温度升高,λ max从333 nm红移至335 nm,荧光强度先降低后升高,在50 ℃降至最低,100 ℃升至最大,这可能是因为鱼肉蛋白色氨酸侧链基团在加热过程中会出现短暂的收缩,达到一定温度后逐渐舒展暴露,直至构象稳定。由图3c可知,随着温度升高,复合肌原纤维蛋白λ max由332 nm红移至336 nm,荧光强度出现2 次上升和下降,在30 ℃和70 ℃达到最高,最后达到稳定。这表明复合肌原纤维蛋白构象随温度变化的规律与猪肉和鱼肉蛋白都不同,蛋白质之间可能发生了相互作用,从而在一定程度上改变了色氨酸对环境的敏感程度,影响了蛋白构象的变化。这种蛋白构象变化规律的改变,可能会对蛋白质热变性过程产生影响,进而在一定程度上改变蛋白质的凝胶特性,改善复合肉制品的品质。
2.4 温度对复合肌原纤维蛋白表面疏水性的影响
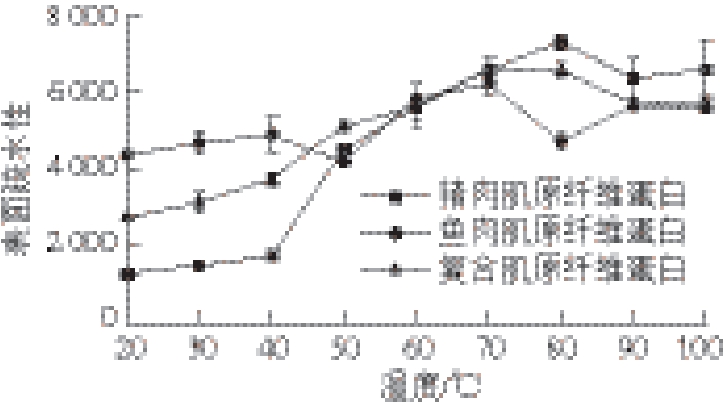
图 4 温度对复合肌原纤维蛋白表面疏水性的影响
Fig. 4 Effects of temperature on surface hydrophobicity of mixed myofibrillar proteins
由图4可知,3 种蛋白的表面疏水性均随温度上升而升高,在70~80 ℃后出现下降并趋于平缓,但具体变化过程却不同。猪肉肌原纤维蛋白表面疏水性从40 ℃开始急剧上升,80 ℃后下降并逐渐稳定;鱼肉肌原纤维蛋白表面疏水性全程变化较平缓,在70 ℃后下降至稳定;复合肌原纤维蛋白表面疏水性在40 ℃开始迅速上升,与猪肉蛋白相似,至70 ℃下降并趋于稳定,与鱼肉蛋白相似,且最终与鱼肉蛋白持平。随着温度升高,维持蛋白质空间构象的作用力逐渐减弱,氢键、范德华力、二硫键等遭到破坏,二级、三级结构发生改变,内部疏水残基暴露,进而引发蛋白质表面疏水区域分布的改变 [26-27]。本实验中,蛋白质表面疏水性与α-螺旋和β-折叠含量呈负相关,与无规则卷曲含量呈正相关,相关研究也证实蛋白质的表面疏水性与α-螺旋含量呈负相关 [28],与β-折叠含量也有密切关系 [21]。但当温度过高时,蛋白质又会发生聚集和侧链间的反应,出现沉淀,导致表面疏水性出现下降 [29-31]。因此3 种肌原纤维蛋白的表面疏水性都是随温度先升高,达到较高温度后出现降低。相关研究也曾报道不同来源的蛋白因结构存在差异而导致表面疏水性不同 [32],因而复合肌原纤维蛋白能够结合猪肉和鱼肉肌原纤维蛋白表面疏水性的变化特点,但复合肌原纤维蛋白表面疏水性的变化规律与单一猪肉和鱼肉蛋白又不完全相同,猪肉和鱼肉肌原纤维蛋白复合后蛋白质之间可能发生了相互作用,改变了原有疏水区域的分布,进而表现出不同的变化规律。
随着温度的升高,猪肉、鲢鱼肉和复合肌原纤维蛋白的浊度都会升高,α-螺旋和无规则卷曲含量降低至稳定,β-折叠含量升高至稳定,蛋白质构象会发生相应变化以适应新环境,表面疏水性均会先升高后在高温下轻微下降至稳定,蛋白质逐渐趋向完全变性。但复合肌原纤维蛋白结构和表面疏水性随温度变化的规律与单一蛋白又不完全相同,不同蛋白之间可能发生了相互作用,影响了蛋白质结构和性质的变化规律。这在结构和机理层面说明,复合肌原纤维蛋白在结合单一蛋白特点的同时,蛋白质间也可能发生相互作用,对蛋白质的凝胶特性产生影响。这将为复合蛋白凝胶、复合肉制品和中低温肉制品的研究提供理论依据和参考。
参考文献:
[1] 耿蕊. pH偏移结合温和热处理对大豆分离蛋白结构及功能性的影响及其与肌原纤维蛋白的互作[D]. 哈尔滨: 东北农业大学, 2015.
[2] PENG Q, KHAN N A, WANG Z, et al. Moist and dry heating-induced changes in protein molecular structure, protein subfractions, and nutrient profi les in camelina seeds[J]. Journal of Dairy Science, 2013, 97(1): 446-457. DOI:10.3168/jds.2013-7298.
[3] 罗嫚. 微波低温加热对猪肉特性影响的研究[D]. 广州: 华南理工大学, 2015.
[4] KHAN N A, BOOKER H, YU P. Effect of heating method on alteration of protein molecular structure in fl axseed: relationship with changes in protein subfraction profi le and digestion in dairy cows[J]. Journal of Agricultural and Food Chemistry, 2015, 63(4): 1057-1066. DOI:10.1021/jf503575y.
[5] THEODORIDOU K, YU P. Application potential of ATR-FT/IR molecular spectroscopy in animal nutrition: revelation of protein molecular structures of canola meal and presscake, as affected by heat-processing methods, in relationship with their protein digestive behavior and utiliz[J]. Journal of Agricultural and Food Chemistry, 2013, 61(23): 5449-5458. DOI:10.1021/jf400301y.
[6] 孔保华, 王宇, 夏秀芳, 等. 加热温度对猪肉肌原纤维蛋白凝胶特性的影响[J]. 食品科学, 2011, 32(5): 50-54.
[7] LIN W L, ZENG Q X, ZHU Z W. Different changes in mastication between crisp grass carp (Ctenopharyngodon idellus C.et V) and grass carp (Ctenopharyngodon idellus) after heating: the relationship between texture and ultrastructure in muscle tissue[J]. Food Research International, 2009, 42(2): 271-278. DOI:10.1016/ j.foodres.2008.11.005.
[8] 赵冰, 周慧敏, 张顺亮, 等. 中温杀菌对乳化香肠蛋白质变化的影响[J].肉类研究, 2016, 30(3): 5-9. DOI:10.15922/j.cnki.rlyj.2016.03.002.
[9] 姜启兴. 鳙鱼肉热加工特性及其机理研究[D]. 无锡: 江南大学, 2015.
[10] 刘蕾, 洪惠, 宋永令, 等. 不同加热条件对复合鱼糜凝胶特性的影响[J].肉类研究, 2010, 24(6): 15-18.
[11] 刘蕾, 王航, 罗永康, 等. 复合鱼肉肌原纤维蛋白加热过程中理化特性变化的研究[J]. 淡水渔业, 2012, 42(3): 88-91. DOI:10.3969/ j.issn.1000-6907.2012.03.018.
[12] 王卫芳. 鱼肉猪肉复合凝胶制品的开发及其影响因素的研究[D]. 武汉: 华中农业大学, 2006.
[13] 杨建雄. 生物化学与分子生物学实验技术教程[M]. 北京: 科学出版社, 2014.
[14] ZHANG Y, ZHONG Q. Probing the binding between norbixin and dairy proteins by spectroscopy methods[J]. Food Chemistry, 2013, 139(1/4): 611-616. DOI:10.1016/j.foodchem.2013.01.073.
[15] LOBLEY A, WHITMORE L, WALLACE B A. DICHROWEB: an interactive website for the analysis of protein secondary structure from circular dichroism spectra[J]. Bioinformatics, 2002, 18(1): 211-212. DOI:10.1016/j.disc.2007.08.079.
[16] 刘茹. 鱼肉和猪肉凝胶的差异及其机制[D]. 武汉: 华中农业大学, 2008.
[17] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254. DOI:10.1006/abio.1976.9999.
[18] WU M C, AKAHANE T, LANIER T C, et al. Thermal transitions of actomyosin and surimi prepared from atlantic croaker as studied by differential scanningcalorimetry[J]. Journal of Food Science, 1984, 50(1): 10-13. DOI:10.1111/j.1365-2621.1985.tb13266.x.
[19] ARAI K I, HASNAIN A U, TAKANO Y I. Species specificity of muscle proteins of fishes against thermal and urea denaturation[J]. Nippon Suisan Gakkaishi, 1976, 42(6): 687-695. DOI:10.2331/ suisan.42.687.
[20] BOURAOUI M, NAKAI S, LI-CHAN E. In situ, investigation of protein structure in Pacific whiting surimi and gels using Raman spectroscopy[J]. Food Research International, 1997, 30(1): 65-72. DOI:10.1016/S0963-9969(97)00020-3.
[21] WANG Z, LI Y, JIANG L, et al. Relationship between secondary structure and surface hydrophobicity of soybean protein isolate subjected to heat treatment[J]. Journal of Chemistry, 2014(5): 1-10. DOI:10.1155/2014/475389.
[22] EFTINK M R, SHASTRY M C R. Fluorescence methods for studying kinetics of protein-folding reactions[J]. Methods in Enzymology, 1997, 278: 258-286. DOI:10.1016/S0076-6879(97)78014-5.
[23] 文鹏程, 余丹丹, 汪昕昕, 等. 不同处理条件对乳铁蛋白构象的影响研究[J]. 光谱学与光谱分析, 2012, 32(1): 162-165. DOI:10.3964/j.is sn.1000-0593(2012)01-0162-04.
[24] 尹燕霞, 向本琼, 佟丽. 荧光光谱法在蛋白质研究中的应用[J]. 实验技术与管理, 2010, 27(2): 33-36. DOI:10.3969/ j.issn.1002-4956.2010.02.011.
[25] 张红梅, 王彦卿, 张根成. 荧光光谱法研究茶碱与牛血清白蛋白的相互作用[J]. 应用化学, 2006, 23(8): 866-870. DOI:10.3969/ j.issn.1000-0518.2006.08.011.
[26] 吴海波, 齐宝坤, 江连洲, 等. 大豆分离蛋白热性质及其空间构象对表面疏水性的影响[J]. 中国粮油学报, 2014, 29(10): 42-46.
[27] 郭丽萍, 熊双丽, 黄业传. 超高压结合热处理对猪肉蛋白质相互作用力及结构的影响[J]. 现代食品科技, 2016(2): 196-204. DOI:10.13982/j.mfst.1673-9078.2016.2.030.
[28] KATO A, MATSUDA T, MATSUDOMI N, et al. Determination of protein hydrophobicity using a sodium dodecyl sulfate binding method[J]. Journal of Agricultural and Food Chemistry, 2002, 32(2): 284-288. DOI:10.1021/jf00122a027.
[29] 余晶梅. 荧光探针法和疏水相互作用层析法分析蛋白表面疏水性[D].杭州: 浙江大学, 2014.
[30] 黄曼, 卞科. 理化因子对大豆蛋白疏水性的影响[J]. 郑州工程学院学报, 2002, 23(3): 5-9. DOI:10.3969/j.issn.1673-2383.2002.03.002.
[31] 吕彤, 林俊杰, 周昌瑜, 等. 热处理强度对猪肉肌球蛋白结构及风味成分吸附特性的影响[J]. 农业工程学报, 2016, 32(8): 285-291. DOI:10.11975/j.issn.1002-6819.2016.08.040.
[32] 许晶, 齐宝坤, 赵青山, 等. 大豆分离蛋白结构特性与表面疏水性的关系[J]. 中国粮油学报, 2015, 30(8): 32-36. DOI:10.3969/ j.issn.1003-0174.2015.08.006.
Effects of Temperature on the Structure and Surface Hydrophobicity of Mixed Myofibrillar Proteins
LI Qingzheng
1, ZHANG Shunliang
2, LUO Yongkang
1, FENG Ligeng
1,*
(1.College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China;
2. China Meat Research Center, Beijing 100068, China)
Abstract:Temperature is a main factor that affects the change of protein structure and function. This study researched the changes with temperature in secondary structures, conformation, turbidity and surface hydrophobicity of pork and silver carp myofi brillar proteins (MP) as well as their mixture (1:1, m/m) and correlated protein secondary structures with surface hydrophobicity. The results indicated that for all three MP samples, turbidity increased; the contents of α-helix and random coil decreased to a constant level, and β-corner added to constant; protein conformation changed and tended to be stable to adapt to the new environment; surface hydrophobicity increased and then decreased slightly to a stable level with temperature. As a result, the proteins tended to be completely denaturated. The thermal denaturation profile of the pure myofi brillar proteins was not completely the same as that of the mixed ones. The mixture could combine the advantages of pork MP and silver carp MP, and improved their properties with temperature.
Key words:myofi brillar protein; pork; silver carp; mixed; temperature; structure; surface hydrophobicity
DOI:10.7506/rlyj1001-8123-201702002
中图分类号:TS251.1
文献标志码:A
文章编号:1001-8123(2017)02-0006-05
收稿日期:2016-08-11
基金项目:“十二五”国家科技支撑计划项目(2015BAD28B00);国家现代农业产业技术体系建设专项(CARS-46)
作者简介:李清正(1991—),男,硕士研究生,研究方向为水产品加工及贮藏。E-mail:haidaqingzheng@163.com
*通信作者:冯力更(1961—),女,副教授,硕士,研究方向为食品安全与质量保证。E-mail:fengligeng@cau.edu.cn
引文格式:
李清正, 张顺亮, 罗永康, 等. 温度对复合肌原纤维蛋白结构及其表面疏水性的影响[J]. 肉类研究, 2017, 31(2): 6-11.
DOI:10.7506/rlyj1001-8123-201702002. http://www.rlyj.pub
LI Qingzheng, ZHANG Shunliang, LUO Yongkang, et al. Effects of temperature on the structure and surface hydrophobicity of mixed myofibrillar proteins[J]. Meat Research, 2017, 31(2): 6-11. DOI:10.7506/rlyj1001-8123-201702002. http://www.rlyj.pub