
图 1 猪背膘整合水平对重组干腌火腿成熟期间POV的影响(n =4)
Fig. 1 Effect of added pig back fat levels on the POV of RDCH during ripening (n=4)
惠 腾1,戴瑞彤1,*,彭增起2,喻倩倩1,田晓静1
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.南京农业大学食品科技学院,国家肉品质量安全控制工程技术研究中心,江苏 南京 210095)
摘 要:研究外源猪背膘的整合添加对重组干腌火腿成熟过程中的脂质氧化和蛋白质氧化的影响。按照猪背膘的添加水平分别为0%、2%和4%制成生重组火腿,并经过30 d产香成熟过程,制得重组干腌火腿。对整个成熟期间火腿的过氧化值(peroxide value,POV)、过氧化氢含量、硫代巴比妥酸反应物质(thiobarbituric acid reactive substances,TBARs)值、游离自由基含量、蛋白质羰基化合物和巯基化合物含量的变化进行测定,并对重组干腌火腿成熟期间的脂质氧化和蛋白质氧化进行相关性分析。结果表明:在重组干腌火腿的整个成熟过程中,外源猪背膘水平从0%增加到4%能显著促进过氧化物、过氧化氢和丙二醛等脂质氧化产物的生成(P<0.05);仅在4%猪背膘处理组重组干腌火腿成熟末期检测到了游离自由基,说明重组干腌火腿成熟期间游离自由基的生成与成熟时间和脂肪含量有关;蛋白质氧化在火腿成熟前期并不显著(P>0.05),其主要发生在成熟后期,并受脂肪含量的影响,外源猪背膘水平从0%增加到4%能显著促进火腿成熟后期蛋白质羰基化合物的生成,降低巯基含量(P<0.05);重组干腌火腿成熟期间的蛋白质羰基化合物含量与H2O2含量(r=0.44,P<0.05)和TBARs值(r=0.94,P<0.01)均有显著的正相关性,说明火腿成熟过程中的脂质氧化与蛋白质氧化具有正相关性。
关键词:重组干腌火腿;猪背膘;脂质氧化;蛋白质氧化;游离自由基
Abstract: The aim of the present study was to evaluate the effect of incorporating pig back fat in restructured dry cured ham (RDCH) on the lipid and protein oxidation during ripening. Fresh raw ham butts were skinned, boned, and cut into meat cubes ((4–6) cm × (4–6) cm× (4–6) cm). The meat cubes were restructured with 0% (control), 2% and 4% pig back fat paste respectively into raw restructured ham. After 30 days of ripening, peroxide value (POV), hydrogen peroxide (H2O2),free radical, thiobarbituric acid reactive substances (TBARs), carbonyl and sulfhydryl group (SH) were detected, and the correlation between lipid oxidation and protein oxidation was analyzed. Results indicated that the contents of peroxide, H2O2and TBARs in RDCH increased with the increasing amount of added pig back fat level from 0% to 4%, and free radical was only detected in the 4% treatment group in the late period of ripening by electron spin resonance spectroscopy (ESR),suggesting that the generation of free radical in RDCH was related to the ripening time and fat level. The oxidation of muscle protein in RDCH was mild in the early period of ripening; however it mainly occurred in the late period of ripening and was affected by fat level. The content of carbonyl groups and the reduction of SH groups in RDCH increased significantly with the increasing amount of added pig back fat level from 0% to 4% during the late period of ripening (P < 0.05). Correlation analysis showed that the carbonyl content in RDCH had significant positive correlations with both H2O2(r = 0.44, P < 0.05)and TBARs (r = 0.94, P < 0.01), suggesting that lipid oxidation had a positive correlation with protein oxidation in RDCH during ripening.
Key words: restructured dry cured ham; pig back fat; lipid oxidation; protein oxidation; free radical
脂质氧化是肉制品加工与贮藏过程中一种重要的生物化学变化,干腌肉制品的脂质氧化过程能够形成许多挥发性化合物,它们对干腌肉制品的香味起着重要作用,是干腌肉制品形成独特风味不可或缺的途径,但脂质氧化也会引起肉制品的酸败,形成不愉快的味道[1-2]。在干腌火腿的加工过程中,盐含量、温度以及它们的交互作用对脂质氧化有显著影响[1],高温和长时间的成熟过程均能促进脂质氧化。其他影响脂质氧化的因素包括原料肉的pH值、高压处理、肌肉类型和硝化细菌的添加等[3-6]。
作为肌肉组织的主要成分,蛋白质对肉制品的感官、营养和加工特性起着重要作用,蛋白质的变化对肉制品的质构、颜色、香味等质量特性有重要影响[7-9]。肌肉蛋白质氧化会导致蛋白质发生多种物理化学变化,包括氨基酸修饰、溶解性降低、活性消失及消化率降低等[10],进而影响肉制品质量。蛋白质氧化受温度、加工条件、催化剂和抑制剂等因素的影响[7],巯基含量[11]和蛋白质羰基含量[12-13]往往用于评价肉类制品中蛋白质的氧化程度。
Lorenzo等[14]的研究表明,在香肠中添加外源脂质能够促进香肠中的脂质氧化;Viljanen等[15]发现脂质氧化很容易通过一系列反应过渡到蛋白质氧化;Utrera等[16]的研究表明,牛肉饼冻藏过程中的脂肪含量与蛋白质氧化显著相关,高脂肪含量的牛肉饼冻藏过程中的蛋白质氧化更剧烈。重组干腌火腿是将外源脂肪整合进入瘦肉中成型,再经过较长时间的成熟产香制得。脂肪对于重组干腌火腿成熟过程中香味的形成起着重要作用,但较高的脂质含量会引起脂质与蛋白质的过度氧化,进而导致火腿质量下降。本研究对外源猪背膘的添加对重组干腌火腿成熟过程中脂质与蛋白质氧化的影响进行探究,并对火腿成熟过程中脂质氧化与蛋白质氧化的相关性进行分析。
1.1 材料与试剂
杜长大三元杂交猪猪后腿15 条。三元杂交猪来自于集中饲养,屠宰平均月龄7 个月,体质量100 kg左右。
N-叔丁基-α-苯基硝酮(N-tert-butyl-alphaphenylnitrone,PBN,纯度98%)、2-(N-吗啡啉)乙磺酸(2-(N-morpholino)ethanesulfonic acid,MES,纯度98%)、硫代巴比妥酸(纯度99%) 美国Sigma-Aldrich公司;A06-1过氧化氢试剂盒 南京建成科技有限公司;5,5’-二硫双(2-硝基苯甲酸)(5,5’-dithio-bis(2-nitrobenzoic acid),DTNB,纯度≥99%)、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH,纯度98%) 上海迈瑞尔化学技术有限公司;谷氨酰胺转氨酶(100 U/g) 江苏一鸣生物股份有限公司;其他试剂均为国产分析纯。所用添加剂均为食品级。
1.2 仪器与设备
BJBJ-60搅拌机 杭州爱博食品机械有限公司;UMC 5斩拌机 德国Stephan公司;Binder KBF 720恒温恒湿箱 上海捷沪仪器仪表有限公司;DU 730紫外-可见分光光度计 美国Beckman Coulter公司;A300-10/12电子顺磁共振波谱仪 德国Bruker公司;BD115电热恒温培养箱 德国Binder公司。
1.3 方法
1.3.1 实验设计
参考Hui等[17-18]的方法。每个生重组火腿的质量均为2 kg,外源脂肪添加水平分别为0%(对照组)、2%和4%;生重组火腿经过脱水和成熟产香后得重组干腌火腿;成熟阶段结束后,将整个重组干腌火腿绞碎,混合均匀,用于各项指标测定。
1.3.2 重组干腌火腿的制备
1.3.2.1 原料肉处理
在4 ℃条件下将15 条猪后腿去皮、去骨,修掉可见的结缔组织,猪背膘取自相应生猪。
猪背膘处理:将猪背膘切成小块,分别称取0.04、0.08 kg(对应于猪背膘添加水平分别为2%和4%的生重组火腿),置于斩拌机中,均添加60 g蒸馏水和20 g酪蛋白酸钠,4 ℃、2 400 r/min条件下斩拌8 min,备用。
将猪后腿肉切成(4~6) cm×(4~6) cm×(4~6) cm的肉块,分别称取2.00、1.96、1.92 kg,加入相应质量的猪背膘,使猪背膘的添加水平分别为0%、2%和4%;将各组猪后腿肉和猪背膘分别放入搅拌机中,均添加80 g氯化钠和0.30 g亚硝酸钠,4 ℃、12 r/min条件下搅拌10 min,备用。
1.3.2.2 生重组火腿的制备
将上述3 组处理好的猪后腿肉和猪背膘混合物分别放入搅拌机中,4 ℃、12 r/min条件下搅拌30 min;向各组添加10 g谷氨酰胺转氨酶,继续搅拌30 min;将3 组搅拌后的混合物分别装入不锈钢模具中,4 ℃冷凝重组10 h;10 h后脱模,样品用铝箔袋抽真空包装,-18 ℃冻藏6 h;冻藏结束后去掉铝箔袋即可。共制备60 个质量为2 kg的生重组火腿,其中每组各20 个。
1.3.2.3 重组干腌火腿的成熟
将制备好的生重组火腿填充到胶原蛋白肠衣中,放入恒温恒湿箱。
成熟过程:第1阶段,前期脱水,温度(10±2) ℃,湿度(85±5)%;当火腿平均失重率达(12±3)%时进入第2阶段,温度(20±2) ℃,湿度(75±5)%,用于重组火腿的中期成熟;当火腿平均失重率达(35±5)%时进入第3阶段,调整温度为(25±2) ℃,用于重组火腿的后期成熟。当火腿平均失重率达47%左右时停止成熟工艺,总时间约为30 d。分别在0、8、16、25、30 d取样,用于各项指标测定。
1.3.3 指标测定
过氧化值(peroxide value,POV)测定:参照GB/T 5009.37—2003《食用植物油卫生标准的分析方法》[19];过氧化氢(hydrogen peroxide,H2O2)含量测定:采用A06-1试剂盒进行测定;硫代巴比妥酸反应物质(thiobarbituric acid reactive substances,TBARs)值测定:参照张露等[20]的方法;蛋白质羰基值测定:采用二硝基苯肼法[21];总巯基含量测定:采用Sun Weizheng等[22]的方法。
游离自由基含量测定:1)MES-Buffer的配制:称取5.33 g MES,溶于0.5 L去离子水,得到50 mmol/L的MES-Buffer,用NaOH溶液调节其pH值至5.7,4 ℃保存;2)PBN自旋捕获剂的配制:称取14.18 g PBN,溶于200 mL 96%乙醇,得到0.4 mol/L的PBN混合液;3)将2.85 g重组干腌火腿样品加入到28.5 mL MES-Buffer和1.5 mL PBN混合液中。用匀浆机匀浆30 s,分装(每袋4.5 mL),真空包装,A300-10/12电子顺磁共振波谱仪测定。测定参数为:微波功率2.5 mW,扫描宽度180 G,调制频率100 kHz,调制幅度10 G,扫描时间168 s,转换时间164 ms,时间常数164 ms,每个样本的扫描数为10。
1.4 数据处理
采用SPSS Statistics 20软件中的单项方差分析(analysis of variance,ANOVA)对数据进行分析,采用最小显著差异程序(least significant difference,LSD)对平均值进行比较分析,显著性水平为P=0.05。
2.1 重组干腌火腿的脂质氧化情况
2.1.1 加工过程中的POV变化
由图1可知,生重组火腿的POV为0.043~0.047 g/100 g脂质,3 个处理组间无显著性差异(P>0.05)。成熟时间对重组干腌火腿的POV有显著影响(P<0.05),成熟0~8 d时,火腿的POV急剧增加,第8天时达到最大值,此时对照组、猪背膘添加水平分别为2%和4%组样品的POV与生重组火腿相比分别增加了53.4%、54.3%和85.1%;成熟前8 d内,猪背膘添加水平为4%的样品POV显著高于0%和2%处理组(P<0.05),表明猪背膘的增加促进了脂质初级氧化产物的生成;成熟8 d后,各组样品的POV逐渐降低,直至成熟结束,POV的降低应该是脂质初级氧化产物进一步降解生成二级氧化产物的结果。Glykeria等[23]在干腌肉制品加工过程中也观察到了类似的现象,从成熟第8天到第30天,0%、2%和4%处理组样品的POV分别降低了0.023、0.024、0.026 g/100 g脂质,表明猪背膘含量的增加可能会促进干腌肉制品中脂质初级氧化产物的降解。

图 1 猪背膘整合水平对重组干腌火腿成熟期间POV的影响(n =4)
Fig. 1 Effect of added pig back fat levels on the POV of RDCH during ripening (n=4)
2.1.2 加工过程中的TBARs值变化
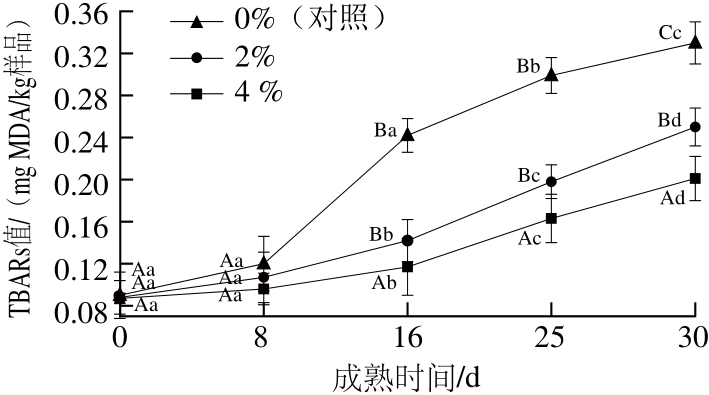
图 2 猪背膘整合水平对重组干腌火腿成熟期间TBARs值的影响(n=4)
Fig. 2 Effect of added pig back fat levels on the TBARs of RDCH during ripening (n=4)
由图2可知,生重组火腿的TBARs值为0.087~0.090 mg MDA/kg样品,3 个处理组间无显著性差异(P>0.05)。成熟时间对重组干腌火腿的TBARs值有显著影响(P<0.05),成熟前8 d内,各组样品的TBARs值逐渐增加,但与生重组火腿间没有显著差异(P>0.05);成熟第8天到第16天,对照组样品TBARs值增加缓慢,但2 个处理组样品的TBARs值显著增加,与成熟第8天相比分别增加了32.7%和101.6%;成熟16 d后,各组样品的TBARs值急速增加直至成熟结束。Bermúdez等[24]发现干腌Celta火腿的TBARs值与氯化钠含量呈显著正相关(r=0.55,P<0.01),认为可能的原因是氯化钠中存在金属杂质,从而起到了促氧化的作用;Fan Wenjiao等[25]研究发现,在高温条件下加工的猪肉肠,其TBARs值会高于低温条件下加工的产品,这是由于温度的升高会促进脂质氧化的发生。本研究中样品的TBARs值在成熟后期急剧增加的原因可能是成熟后期氯化钠含量的上升或温度的升高,或是二者相互作用的结果。成熟30 d时,高猪背膘水平重组干腌火腿的TBARs值显著高于低猪背膘水平组(P<0.05);与相应的生重组火腿相比,0%、2%和4%处理组火腿的TBARs值分别增加了0.114、0.162、0.240 mg MDA/kg样品,表明增加猪背膘水平可以促进脂质二级氧化产物的形成。
2.1.3 加工过程中的H2O2含量变化
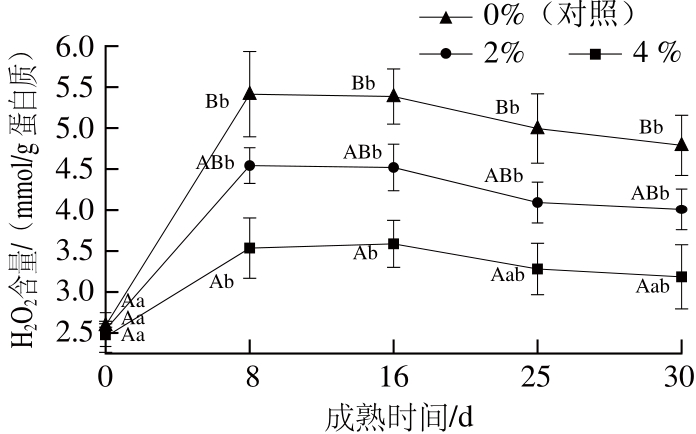
图 3 猪背膘整合水平对重组干腌火腿成熟期间H2O2含量的影响(n=4)
Fig. 3 Effect of added pig back fat levels on the H2O2content of RDCH during ripening (n= 4)
H2O2作为一种过氧化物,不仅是诱发肉制品蛋白质氧化的活性氧物质,而且还能通过芬顿反应生成羟自由基,参与蛋白质氧化。由图3可知,在30 d的成熟过程中,样品的H2O2含量均非常低,生火腿中的H2O2含量约为2.5 mmol/g蛋白质。成熟前8 d内,各组样品的H2O2含量显著上升,第8天时达到最大值,此时0%、2%和4%处理组火腿的H2O2含量与生火腿相比分别增加了44.1%、78.7%和108.9%。猪背膘水平越高,火腿中H2O2的含量越高,表明提高猪背膘水平能够促进H2O2的生成,其原因可能是猪背膘整合水平的提高促进了重组干腌火腿加工过程中总过氧化物的生成,作为一种过氧化物,H2O2的生成量可能也随之提高。成熟8 d后,各组样品的H2O2含量逐渐降低直至成熟结束,但是从成熟第8天到第30天,各组样品的H2O2含量没有显著变化(P>0.05)。成熟第30天时,0%、2%和4%处理组样品的H2O2含量分别为3.18、4.00、4.78 mmol/g蛋白质。
2.1.4 成熟第30天时的游离自由基信号强度
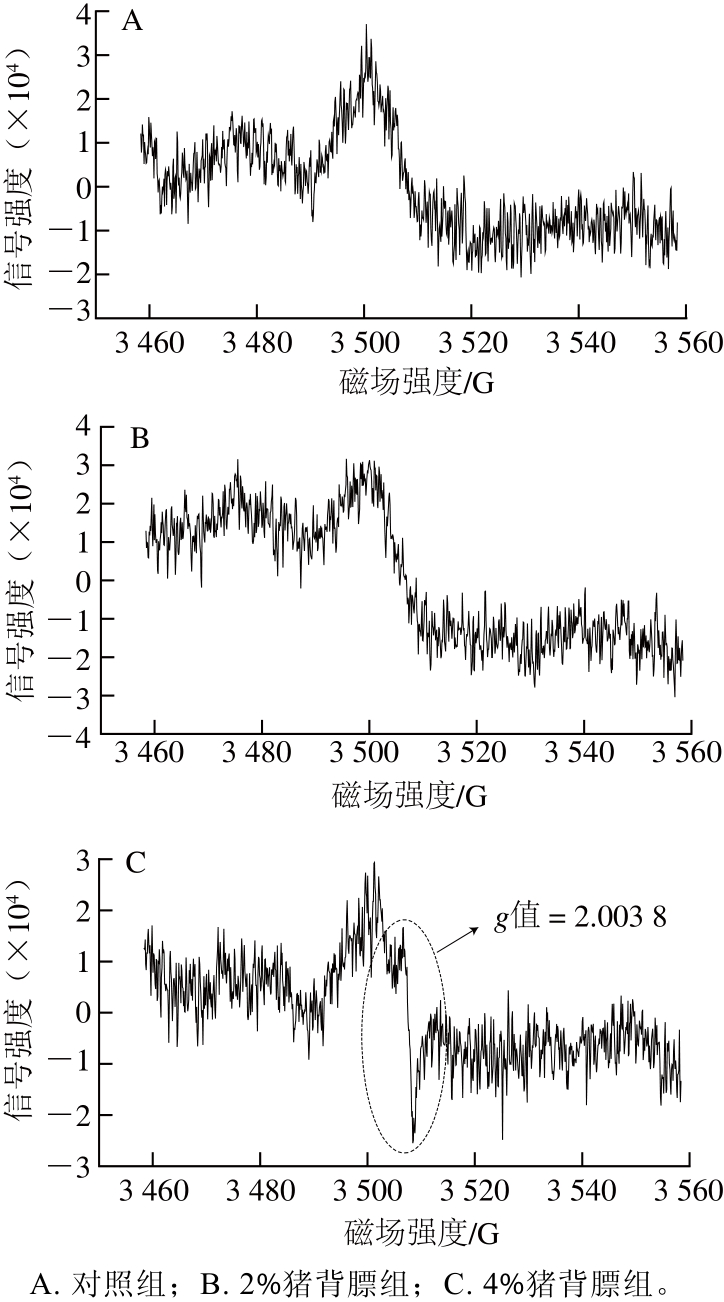
图 4 猪背膘整合水平对重组干腌火腿成熟第30天时游离自由基信号强度的影响
Fig. 4 Effect of added pig back fat levels on the intensity of free radical in RDCH at day 30
由图4可知,成熟30 d时,只有4%猪背膘处理组的样品在磁场强度3 500~3 520 G之间检测到了自由基,该自由基g值为2.003 8,这表明干腌肉制品中自由基的生成可能与成熟时间和脂肪含量有关,高脂肪含量可能促进了干腌肉制品成熟后期游离自由基的生成。g值对自由基的结构判别起着重要作用。赵保路[26]指出,g值在2.003 0~2.005 0之间的自由基可能为半醌自由基,然而自由基真实结构的判断还必须结合自由基在磁场中的超精细分裂图谱。在本研究中,4%猪背膘处理组重组干腌火腿的游离自由基含量较少,导致其信号较弱,因而无法获得超精细分裂图谱,从而无法判断所检测到自由基的真实结构和种类。
综上所述,提高重组干腌火腿中猪背膘的水平加剧了成熟期间的脂质氧化,促进了脂质初级和次级氧化产物的形成。脂质氧化机制一般分为自由基自动氧化机制和脂肪氧合酶介导的酶促氧化机制,当重组干腌火腿中的猪背膘水平从2%增加到4%时,游离自由基的含量显著增加,并在4%处理组中检测到自由基(图4)。因此可以推断,由外源猪背膘水平的增加引起的火腿成熟期间自由基含量的上升可能通过自由基自动氧化机制加剧了脂质的自动氧化。猪背膘水平较高的重组干腌火腿中H2O2含量较高(图3),而H2O2是脂肪氧合酶的激活剂[27],由外源猪背膘水平的增加引起的火腿成熟期间H2O2含量的上升可能通过酶促氧化机制加剧了脂质的酶促氧化。因此,外源猪背膘的整合添加可能通过促进自由基的自动氧化、脂肪氧合酶介导的酶促氧化或二者的共同作用,从而加剧了火腿成熟期间的脂质氧化。
2.2 重组干腌火腿的蛋白质氧化情况
2.2.1 加工过程中的蛋白质羰基含量变化
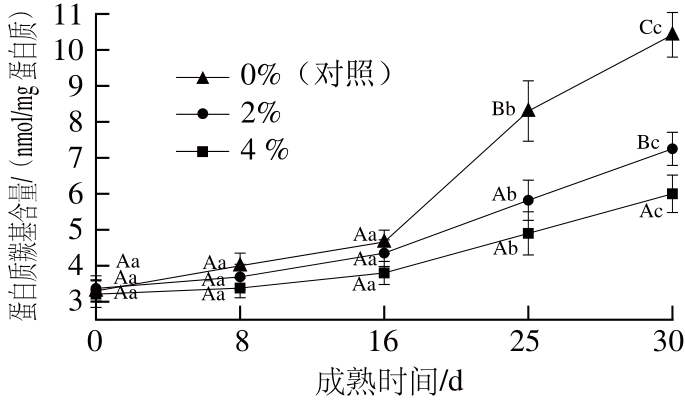
图 5 猪背膘整合水平对重组干腌火腿成熟期间蛋白质羰基含量的影响(n=4)
Fig. 5 Effect of added pig back fat levels on the carbonyl content of RDCH during ripening (n= 4)
由图5可知,生火腿中的羰基含量约为3.30 nmol/mg蛋白质。成熟0~16 d,各组样品的羰基含量逐渐上升,第16天时0%、2%和4%处理组样品的羰基含量与生火腿相比分别增加了0.59、0.98、1.36 nmol/mg蛋白质,但无显著差异(P>0.05),这表明重组干腌火腿成熟早期的蛋白质氧化比较温和。Sun Weizheng等[22]在对广式腊肠成熟期间的蛋白质氧化进行研究时也发现了类似的现象,腊肠成熟前期的蛋白质氧化均没有统计学上的差异。成熟前16 d内,猪背膘的添加水平对样品的羰基含量无显著影响(P>0.05);成熟16 d后,各组样品的羰基含量均急剧升高直至成熟结束,这表明重组干腌火腿的蛋白质氧化主要发生在成熟后期;成熟16~30 d内,猪背膘的添加水平对样品的羰基含量影响显著(P<0.05),高猪背膘水平处理组重组干腌火腿的蛋白质羰基值比低猪背膘水平组显著升高(P<0.05);成熟第30天时,0%、2%和4%处理组样品的蛋白质羰基含量与生火腿相比分别增加了86.9%、115.1%和215.7%,表明猪背膘水平的增加加剧了火腿成熟期间的蛋白质氧化。Utrera等[16]发现牛肉饼冻藏期间的脂肪含量与蛋白质氧化存在显著的正相关性。
2.2.2 加工过程中的巯基含量变化
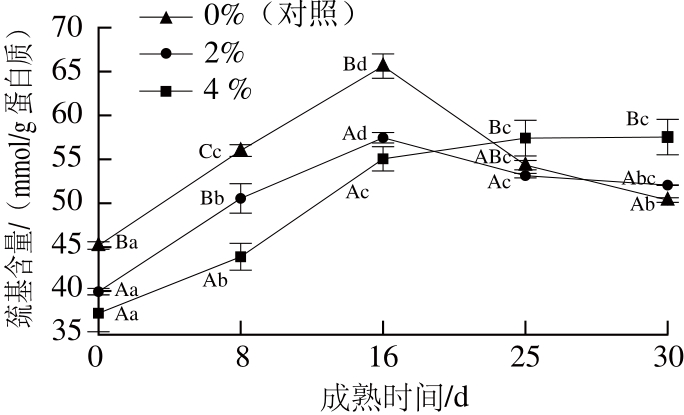
图 6 猪背膘整合水平对重组干腌火腿成熟期间巯基含量的影响(n=4)
Fig. 6 Effect of added pig back fat levels on the sulfhydryl group content of RDCH during ripening (n= 4)
由图6可知,成熟0~16 d,各组样品的巯基含量均逐渐升高,这可能是由于成熟前期蛋白质水解引起二硫键断裂所致;成熟16 d后,对照组样品的巯基含量仍然保持相对平稳,直至成熟结束,但2%和4%处理组样品的巯基含量均急剧下降直至成熟结束,该阶段样品中巯基含量的显著下降与蛋白质羰基含量的显著上升完全吻合,表明火腿成熟后期的蛋白质氧化剧烈,蛋白质之间可能会通过形成二硫键发生蛋白质聚集,因此导致2%和4%处理组样品中巯基含量显著下降。从成熟第16天到第30天,2%和4%处理组样品的巯基含量分别降低了7.5%和17.2%。综上所述,猪背膘的添加促进了重组干腌火腿成熟期间的蛋白质氧化,从而导致羰基值的上升和巯基含量的下降。自由基(如超氧自由基(HO2·)和羟自由基(·OH))和非自由基类物质(如H2O2和氢过氧化物(ROOH)等)都是诱发蛋白质氧化的活性氧物质[7]。添加猪背膘可以促进H2O2和自由基等活性氧物质的形成,因此高猪背膘处理组样品中较高含量的活性氧物质可能促进了火腿成熟期间蛋白质的氧化。同时,由于Fe2+和H2O2的芬顿反应可以生成氧化活性极强的·OH,·OH与蛋白质的反应速率大于与脂质的反应速率[28],因此高猪背膘处理组样品中高含量的H2O2可以通过芬顿反应生成更多的·OH,从而促进火腿成熟期间蛋白质的氧化。
2.3 脂质氧化与蛋白质氧化的相关性
表 1 重组干腌火腿成熟期间脂质氧化与蛋白质氧化的相关性分析
Table 1 Correlation between lipid oxidation and protein oxidation

注:**. 在0.01水平(双侧)显著相关;*. 在0.05水平(双侧)显著相关。
由表1可知,重组干腌火腿成熟期间的羰基含量与POV没有显著相关性(P>0.05),但与H2O2含量和TBARs值均有显著正相关性,这表明火腿成熟期间的脂质氧化与蛋白质氧化存在显著正相关性。Ventanas等[29]发现干腌通脊成熟期间的蛋白质氧化(蛋白质羰基含量)与丙二醛含量具有显著的正相关性(r=0.52,P<0.01);Estévez等[30]也发现西班牙传统肉制品“liver pâté”贮藏期间的蛋白质氧化(蛋白质羰基含量)与TBARs值存在显著的正相关性(r=0.71,P<0.01),这些结果均表明脂质氧化与蛋白质氧化存在相关性。Estévez[7]的研究表明,脂质介导的活性氧,如过氧自由基(ROO·)是蛋白质氧化潜在的诱发剂,并指出在肉类系统中,脂肪氧化与蛋白质氧化具有交互性,在这个交互过程中,脂肪氧化与蛋白质氧化可能存在活性或非活性物质的相互迁移。Park等[31]的研究表明,不饱和脂肪酸氧化所产生的自由基或氢过氧化物能够攻击氨基酸侧链,使蛋白质氧化形成羰基化合物;体外实验进一步表明,在肌原纤维蛋白金属催化和脂肪氧化系统中,脂肪氧化与蛋白质氧化具有一定的偶联性。
重组干腌火腿成熟前期的POV显著增加,后期逐渐下降,H2O2含量在成熟前期上升,然后保持平稳直至成熟结束,TBARs值和蛋白质羰基值在整个成熟过程中逐渐增加直至成熟结束,对照组火腿样品的巯基含量先上升后保持平稳,而添加猪背膘重组干腌火腿的巯基含量成熟前期上升,成熟后期显著下降。猪背膘的添加对重组干腌火腿成熟期间的蛋白质氧化和脂质氧化有显著影响,猪背膘的添加能够促进火腿成熟期间H2O2含量、POV和TBARs值的升高,促进游离自由基和蛋白质羰基化合物的形成,降低成熟后期的巯基含量。蛋白质氧化主要发生在重组干腌火腿成熟后期。脂质氧化与蛋白质氧化的相关性分析表明:重组干腌火腿成熟期间的脂质氧化与蛋白质氧化存在显著的正相关性,猪背膘的添加可能会引起重组干腌肉制品成熟期间脂质自由基和蛋白质自由基的增加。脂质和蛋白质自由基的种类和结构分析将在后续的研究中继续探讨。
参考文献:
[1] HARKOUSS R, ASTRUC T, LEBERT A, et al. Quantitative study of the relationships among proteolysis, lipid oxidation, structure and texture throughout the dry-cured ham process[J]. Food Chemistry,2015, 166(11): 522-530. DOI:10.1016/j.foodchem.2014.06.013.
[2] FRANKEL E N. Volatile lipid oxidation products[J]. Progress in Lipid Research, 1983, 22(1): 1-33. DOI:10.1016/0163-7827(83)90002-4.
[3] BUSCAILHON S, BERDAGUE J L, GANDERMER G, et al. Effect of initial pH on compositional changes and sensory traits of French dry-cured hams[J]. Journal of Muscle Foods, 2010, 5(3): 257-270.DOI:10.1111/j.1745-4573.1994.tb00535.x.
[4] FUENTES V, UTRERA M, ESTEVEZ M, et al. Impact of high pressure treatment and intramuscular fat content on colour changes and protein and lipid oxidation in sliced and vacuum-packaged Iberian dry-cured ham[J]. Meat Science, 2014, 97(4): 468-474. DOI:10.1016/j.meatsci.2013.12.018.
[5] JIN Guofeng, HE Lichao, ZHANG Jianhao, et al. Effects of temperature and NaCl percentage on lipid oxidation in pork muscle and exploration of the controlling method using response surface methodology (RSM)[J]. Food Chemistry, 2012, 131(3): 817-825.DOI:10.1016/j.foodchem.2011.09.050.
[6] GRATACOS-CUBARSI M, SARRAGA C, CASTELLARI M, et al.Effect of pH24h, curing salts and muscle types on the oxidative stability, free amino acids profile and vitamin B2, B3and B6content of dry-cured ham[J]. Food Chemistry, 2013, 141(3): 3207-3214.DOI:10.1016/j.foodchem.2013.06.016.
[7] EST☒VEZ M. Protein carbonyls in meat systems: a review[J]. Meat Science, 2011, 89(3): 259-279. DOI:10.1016/j.meatsci.2011.04.025.
[8] KEMP C M, SENSKYP L, BARDSLEY R G, et al. Tenderness: an enzymatic view[J]. Meat Science, 2010, 84(2): 248-256. DOI:10.1016/j.meatsci.2009.06.008.
[9] KAZEMI S, NGADI M O, GARIEPY C. Protein denaturation in pork longissimus muscle of different quality groups[J]. Food and Bioprocess Technology, 2011, 4(1): 102-106. DOI:10.1007/s11947-009-0201-3.
[10] XIONG Y L. Protein oxidation and implications for muscle food quality:antioxidants in muscle foods[M]. New York: Wiley, 2000: 85-111.
[11] FREDERIKSEN A M, LUND M N, ANDERSEN M L, et al.Oxidation of porcine myosin by hypervalent myoglobin: the role of thiol groups[J]. Journal of Agricultural and Food Chemistry, 2008,56(9): 3297-3304. DOI:10.1021/jf072852p.
[12] RUI G, DAVID M, MARIO E. Protein oxidation in emulsified cooked burger patties with added fruit extracts: influence on colour and texture deterioration during chill storage[J]. Meat Science, 2010, 5(3): 402-409.DOI:10.1016/j.meatsci.2010.02.008.
[13] GALEGO M, MORA L, ARISTOY M C, et al. Evidence of peptide oxidation from major myofibrillar proteins in dry-cured ham[J]. Food Chemistry, 2015, 187: 230-235. DOI:10.1016/j.foodchem.2015.04.102.
[14] LORENZO J M, FRANCO D. Fat effect on physico-chemical,microbial and textural changes through the manufactured of dry-cured foal sausage lipolysis, proteolysis and sensory properties[J]. Meat Science, 2012, 92(4): 704-714. DOI:10.1016/j.meatsci.2012.06.026.
[15] VILJANEN K, KIVIKARI R, HEINONEN M. Protein-lipid interactions during liposome oxidation with added anthocyanin and other phenolic compounds[J]. Journal of Agricultural and Food Chemistry, 2004, 52(5): 1104-1111. DOI:10.1021/jf034785e.
[16] UTRERA M, MORCUENDE D, ESTEVEZ M. Fat content has a significant impact on protein oxidation occurred during frozen storage of beef patties[J]. LWT-Food Science and Technology, 2014, 56(1):62-68. DOI:10.1016/j.lwt.2013.10.040.
[17] HUI T, ZHANG Y W, AMALI M A, et al. Incorporation of pig back fat in restructured dry cured ham to enhance the lipase and lipoxygenase activities[J]. European Journal of Lipid Science and Technology, 2017,119(2). DOI:10.1002/ejlt.201500581.
[18] HUI T, ZHANG Y W, AMALI M A, et al. Incorporation of pig back fat in restructured dry cured ham to facilitate the release of unsaturated fatty acids and generation of volatile compounds[J]. European Journal of Lipid Science and Technology, 2017, 119(2). DOI:10.1002/ejlt.201600025.
[19] 上海市卫生防疫站, 天津市卫生防疫站, 安徽省卫生防疫站, 等.GB 5009.37—2003 食用植物油卫生标准的分析方法[S]. 北京: 中国标准出版社, 2003.
[20] 张露, 张雅玮, 惠腾, 等. 低钠盐对干腌肉制品加工过程中理化特性的影响[J]. 食品科学, 2014, 35(17): 77-82. DOI:10.7506/spkx1002-6630-201417016.
[21] ARMENTEROS M, HEINONEN M, OLLIAINEN V, et al. Analysis of protein carbonyls in meat products by using the DNPH-method,fluorescence spectroscopy and liquid chromatography-electrospray ionisation-mass spectrometry (LC-ESI-MS)[J]. Meat Science, 2009,83(1): 104-112. DOI:10.1016/j.meatsci.2009.04.007.
[22] SUN Weizheng, ZHAO Mouming, YANG Bao, et al. Oxidation of sarcoplasmic proteins during processing of Cantonese sausage in relation to their aggregation behaviour and in vitro digestibility[J]. Food Chemistry, 2011, 88(3): 462-467. DOI:10.1016/j.meatsci.2011.01.027.
[23] GLYKERIA K, SISSE J, SKIBSTED L H. Protein and lipid oxidation in Parma ham during production[J]. Journal of Agricultural and Food Chemistry, 2012, 60(38): 9737-9745. DOI:10.1021/jf3026887.
[24] BERMUDEZ R, FRANCO D, CARBALLO J, et al. Physicochemical changes during manufacture and final sensory characteristics of dry-cured Celta ham[J]. Food Control, 2014, 43: 263-269.DOI:10.1016/j.foodcont.2014.03.028.
[25] FAN Wenjiao, ZHANG Yongkui, CHEN Yunchuan, et al.TBARs predictive models of pork sausages stored at different temperatures[J]. Meat Science, 2014, 96(1): 1-4. DOI:10.1016/j.meatsci.2013.06.025.
[26] 赵保路. 电子自旋共振技术在生物和医学中的应用[M]. 合肥: 中国科学技术大学出版社, 2009: 100-150.
[27] KUHN H, BORCHERT A. Regulation of enzymatic lipid peroxidation:the interplay of peroxidizing and peroxide reducing enzymes[J]. Free Radical Biology and Medicine, 2002, 33(2): 154-172. DOI:10.1016/S0891-5849(02)00855-9.
[28] DAVIES M J. The oxidative environment and protein damage[J].Biochimica Et Biophysica Acta, 2005, 1703(2): 93-109. DOI:10.1016/j.bbapap.2004.08.007.
[29] VENTANAS S, ESTEVEZ M, TEJEDA J F, et al. Protein and lipid oxidation in longissimus dorsi and dry cured loin from Iberian pigs as affected by crossbreeding and diet[J]. Meat Science, 2006, 72(4):647-655. DOI:10.1016/j.meatsci.2005.09.011.
[30] ESTÉVEZ M, CAVA R. Lipid and protein oxidation, release of iron from heme molecule and colour deterioration during refrigerated storage of liver pâté[J]. Meat Science, 2004, 68(4): 551-558.DOI:10.1016/j.meatsci.2004.05.007.
[31] PARK D, XIONG Y L, ALDERTON A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillarprotein[J]. Food Chemistry, 2017, 101(3):1239-1246. DOI:10.1016/j.foodchem.2006.03.028.
Lipid and Protein Oxidation in Restructured Dry Cured Ham during Ripening
HUI Teng1, DAI Ruitong1,*, PENG Zengqi2, YU Qianqian1, TIAN Xiaojing1
(1.College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China; 2.National Center of Meat Quality and Safety Control, College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
DOI:10.7506/rlyj1001-8123-201709002
中图分类号:TS251.1
文献标志码:A
文章编号:1001-8123(2017)09-0007-07
收稿日期:2017-07-25
基金项目:“十三五”国家重点研发计划重点专项(2016YFD040040302)
作者简介:惠腾(1987—),男,博士后,研究方向为肉品加工与质量控制。E-mail:htengui@163.com
*通信作者:戴瑞彤(1966—),女,教授,博士,研究方向为肉品加工与质量控制。E-mail:dairuitong@hotmail.com
引文格式:
惠腾, 戴瑞彤, 彭增起, 等. 重组干腌火腿加工过程中脂质与蛋白质的氧化[J]. 肉类研究, 2017, 31(9): 7-13. DOI:10.7506/rlyj1001-8123-201709002. http://www.rlyj.pub
HUI Teng, DAI Ruitong, PENG Zengqi, et al. Lipid and protein oxidation in restructured dry cured ham during ripening[J].Meat Research, 2017, 31(9): 7-13.
DOI:10.7506/rlyj1001-8123-201709002. http://www.rlyj.pub