李清正,冯力更,罗永康*
(中国农业大学食品科学与营养工程学院,北京 100083)
摘 要:温度是影响蛋白质凝胶特性的主要因素。实验通过研究复合肌原纤维蛋白凝胶(猪肉肌原纤维蛋白、鲢鱼肉肌原纤维蛋白质量比分别为2∶0、1∶1、0∶2)在70、80、90、100 ℃加热时色泽、凝胶强度、质构特性、水分分布的变化,对复合肌原纤维蛋白凝胶和单一肌原纤维蛋白凝胶之间凝胶特性的差异和相关性进行研究,优化蛋白凝胶加热温度。结果表明:1∶1复合的肌原纤维蛋白凝胶能结合单一蛋白凝胶的特点,改善肌原纤维蛋白的凝胶特性;低场核磁共振表明,温度可通过影响水分分布来影响蛋白质的凝胶特性;蛋白凝胶特性随温度升高而增强,但温度过高会出现劣化,90 ℃是较为理想的加热温度。
关键词:肌原纤维蛋白凝胶;复合;猪肉;鲢鱼;凝胶特性;色泽;质构;水分分布
肌原纤维蛋白是肌肉中主要的蛋白质之一,因具有良好的凝胶能力,故而在肉制品加工过程中其凝胶性能的变化直接决定着产品的品质,特别是在糜类肉制品加工中。凝胶特性是蛋白质的主要功能特性之一,包括保水性、流变特性、质构变化等。肌肉蛋白质特别是肌原纤维蛋白的凝胶性能决定肉制品的口感和品质,凝胶的形成有利于提高肉类的保水、保油性,同时也有利于保持食物的营养和风味 [1]。因此研究肌原纤维蛋白凝胶特性的变化对产品开发和实际生产加工具有重要意义。
温度是影响蛋白质凝胶特性的主要因素。随着加热温度的升高,蛋白质结构发生变化,导致水合特性、分子间相互作用等蛋白功能特性发生改变,进而影响蛋白质的凝胶特性 [2]。赵冰等 [3]的研究表明,肌原纤维蛋白凝胶结构的破坏程度随加热温度升高而变大,100 ℃的中温杀菌温度能够很好地保持乳化香肠的质构特性;姜启兴 [4]指出,鳙鱼肌原纤维蛋白中α-螺旋结构随着温度升高逐渐转变为β-折叠、β-转角和无规则卷曲,硬度、咀嚼性呈现先增后降的规律。
近年来,复合蛋白凝胶、复合鱼糜逐渐成为研究热点,不同来源蛋白质之间的相互作用能够改善蛋白凝胶或肉糜的凝胶性能。刘蕾等 [5]研究指出,凝胶化温度为30 ℃,鲢鱼和带鱼鱼糜比例为7∶3时,复合鱼糜凝胶强度高于鲢鱼鱼糜和带鱼鱼糜;刘蕾等 [6]还发现小黄鱼和鲢鱼肌原纤维蛋白1∶1复合后蛋白浊度、巯基含量和Ca 2+-ATPase活性的变化规律与小黄鱼肌原纤维蛋白相似,而不同于鲢肌原纤维蛋白;王卫芳 [7]则推测鱼肉和猪肉肌原纤维蛋白复合后经加热可形成一种复合凝胶,蛋白质间发生了相互作用。但关于温度对复合肌原纤维蛋白凝胶特性影响及其相关性的研究却较少,因此有必要对此开展相应研究。
本实验通过研究加热温度对复合肌原纤维蛋白凝胶色泽、凝胶强度、质构特性、水分分布的影响,对复合肌原纤维蛋白和单一肌原纤维蛋白在凝胶特性方面的变化进行对比,在研究两者之间相关性的同时,优化凝胶加热温度。这将为复合肉制品等新产品的开发,肉制品品质控制和加工工艺优化提供理论依据,同时也为中低温肉制品的发展提供参考。
1.1 材料与试剂
猪肉(后腿精瘦肉)购自北京美廉美超市学院路店;鲢鱼购自北京健翔桥农贸市场,活运至实验室。
所有试剂均为分析纯 北京化学试剂公司。
1.2 仪器与设备
PQ001核磁共振分析仪 上海纽迈电子科技有限公司;TA-XT2i质构仪 广州市博勒飞质构仪技术服务有限公司;FW 2000分散均质机 上海弗鲁克公司;GL-21M超速冷冻离心机 长沙平凡仪器仪表公司;FE20酸度计 梅特勒-托利多(上海)仪器有限公司;WZ-100SP水浴锅 上海申生科技有限公司;全自动色差计 北京辰泰克仪器技术有限公司。
1.3 方法
1.3.1 预处理
猪肉剔去脂肪和结缔组织,切碎后备用。鲢鱼击晕后立即去鳞和内脏,流动水冲洗干净,沥干后取背部白肉备用。
1.3.2 肌原纤维蛋白的提取
参考姜启兴 [4]的方法,略作改进。取5 g肉,加入20 mL pH 7.0的50 mmol/L磷酸缓冲液(含0.1 mol/L NaCl、1 mmol/L乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、2 mmol/L MgCl 2),分散机10 000 r/min均质2 min后于4 ℃条件下8 000 r/min离心15 min,倾去上清液,沉淀重复上述步骤1次。所得沉淀加入20 mL冷的0.1 mol/L NaCl溶液,4 ℃条件下8 000 r/min离心15 min,倾去上清液,沉淀重复洗涤1 次,最后所得沉淀即为肌原纤维蛋白。
1.3.3 肌原纤维蛋白凝胶的制备
参考姜启兴 [4]的方法,略作改动。将肌原纤维蛋白沉淀用pH 6.25的50 mmol/L磷酸盐缓冲液(含0.4 mol/L NaCl)调至质量浓度为60 mg/mL,4 ℃条件下溶胀2 h,分装。称取6 g蛋白液于50 mL离心管,用于测定凝胶色泽、质构;称取2 g蛋白液于5 mL冻存管,用于测定凝胶水分分布。复合蛋白凝胶按猪肉和鲢鱼肌原纤维蛋白质量比1∶1混合均匀制得。采用二段加热法制备凝胶,将离心管和冻存管先置于40 ℃水浴维持30 min,之后分别迅速转移至70、80、90、100 ℃水浴中,加热30 min后立即取出放入冰水浴中降温,放入4 ℃冰箱过夜待测。
1.3.4 蛋白凝胶色泽的测定
采用全自动色差计测定蛋白凝胶的亮度值(L*)、红度值(a*)、黄度值(b*),每个样品测量3 次取平均值,白度值按式(1)计算。
1.3.5 蛋白凝胶强度和质构指标的测定
取形状接近的蛋白凝胶,使用TA-XT2i质构仪测定。硬度、黏性、内聚性、弹性、咀嚼性测试条件:探头类型TPA P/50,测试速率、返回速率均为1 mm/s,压缩比30%,触发力5 g,2 次压缩间隔5 s。凝胶强度测试条件:探头类型TPA P/0.25,测试速率、返回速率均为1 mm/s,压缩比50%,触发力5 g。凝胶强度按式(2)计算。
凝胶强度/(g·mm)=破断力×凹陷度 (2)
式中:破断力为穿刺曲线上的第1个峰值/g;凹陷度为与破断力相对应的破断距离/mm。
1.3.6 蛋白凝胶水分分布的测定
将冻存管中加热后的蛋白凝胶在200 r/min离心3 min,去除表面水分后放入核磁共振分析仪测定水分。测定参数设定:选择CPMG(Carr-Purcell-Meiboom-Gill)序列,测量温度32 ℃,质子共振频率23 MHz,偏移频率286.195 4 kHz,采样点数384 996,累加次数4,PRG=1,模拟增益20,P1=17 μs,P2=35 μs,半回波时间0.12 ms,回波数4 000,Tw=1 600 ms。
1.4 数据处理
使用Excel 2007处理数据,结果以平均值±标准差表示;使用SPSS 21进行显著性差异分析,选择单因素方差分析(analysis of variance,ANOVA),最小显著性差异(least signifi cant difference,LSD)法和Duncan’s方法,在显著性水平0.05进行检验;使用Origin 8.5作图。
2.1 复合肌原纤维蛋白凝胶白度及色泽的变化
温度是影响肌原纤维蛋白凝胶白度和色泽的主要因素,进而能够影响肉的颜色和消费者的选择,因此控制加热温度能够有效改善肉制品的感官品质。
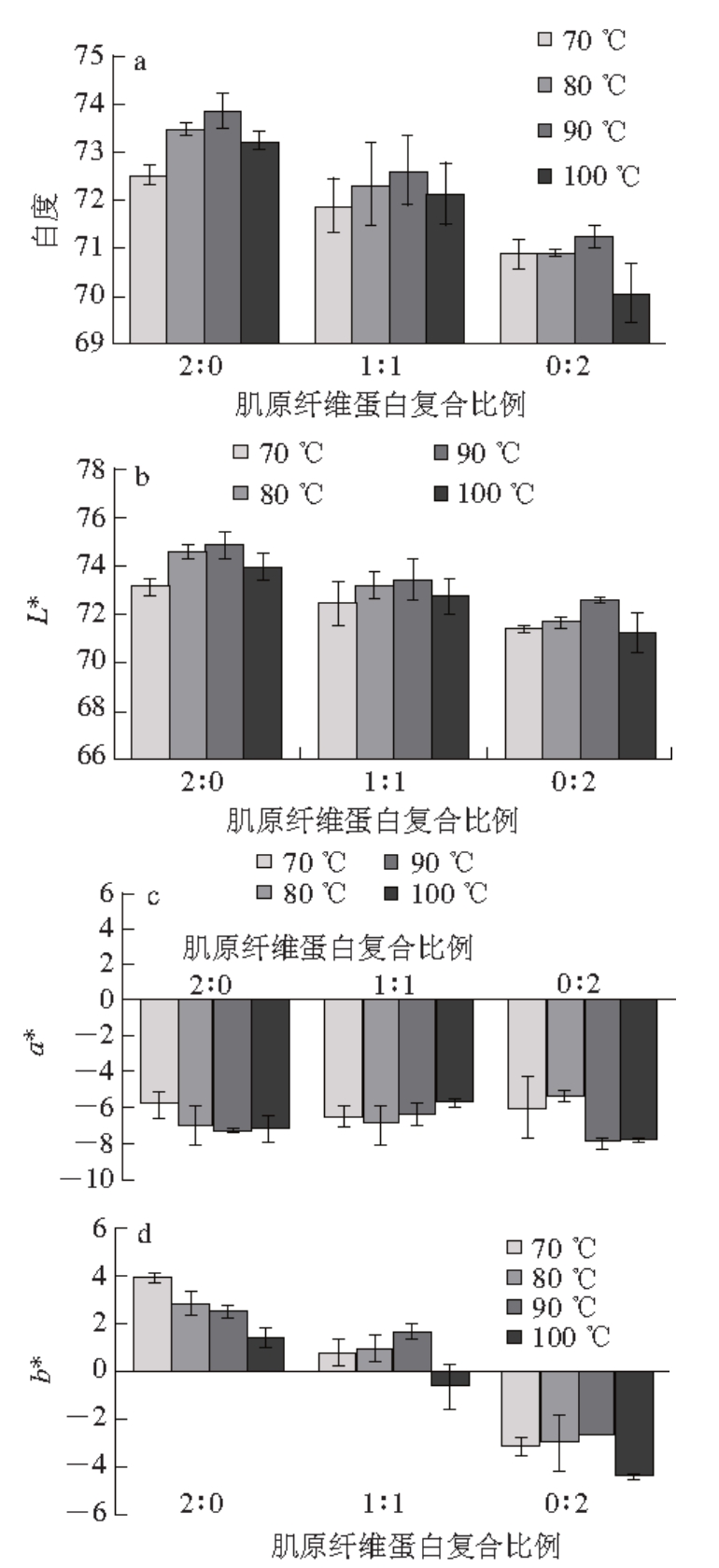
图 1 复合肌原纤维蛋白凝胶白度及色泽的变化
Fig. 1 Changes in whiteness and color of mixed myofibrillar proteins
肌原纤维蛋白复合比例为猪肉肌原纤维蛋白、鲢鱼肉肌原纤维蛋白质量比。下同。
由图1可知,3 种肌原纤维蛋白凝胶的白度随加热温度升高先增加,达到90 ℃后降低,复合肌原纤维蛋白凝胶的白度与单一猪肉、鱼肉肌原纤维蛋白有显著差别(P<0.05),小于猪肉而高于鱼肉肌原纤维蛋白凝胶;肌原纤维蛋白凝胶的亮度值(L*)与白度值变化规律相似,3种蛋白凝胶之间有显著差别(P<0.05),在90 ℃达到最大;3 种肌原纤维蛋白凝胶的红度值(a*)没有显著差别(P>0.05),但复合肌原纤维蛋白凝胶的a*更接近猪肉肌原纤维蛋白凝胶;三者黄度值(b*)有显著差别,其中猪肉肌原纤维蛋白凝胶的b*值随温度升高而减小,鱼肉和复合肌原纤维蛋白凝胶b*随温度升高至90 ℃达最大,100 ℃时出现下降。
相关研究表明,白度与蛋白质变性有很大关系 [8-9]。随着温度升高,肌球蛋白和肌动蛋白逐渐变性 [10],导致蛋白凝胶的白度和亮度升高,a*和b*也发生相应变化。但温度过高时,蛋白质趋向完全变性,甚至出现分解,因此在100 ℃时蛋白凝胶的白度和亮度下降,这也说明加热温度应控制在适宜范围,不宜超过90 ℃。白度较低说明蛋白质变性程度低,蛋白质功能特性发挥不佳,不利于提升蛋白凝胶的感官品质。与单一肌原纤维蛋白凝胶相比,复合肌原纤维蛋白凝胶能够通过综合猪肉和鲢鱼肉肌原纤维蛋白的特点来改善蛋白凝胶的白度和色泽,进而能够提高蛋白凝胶的感官品质,改善肉制品品质,这可能与不同来源的蛋白质之间发生相互作用有关。
2.2 复合肌原纤维蛋白凝胶强度的变化
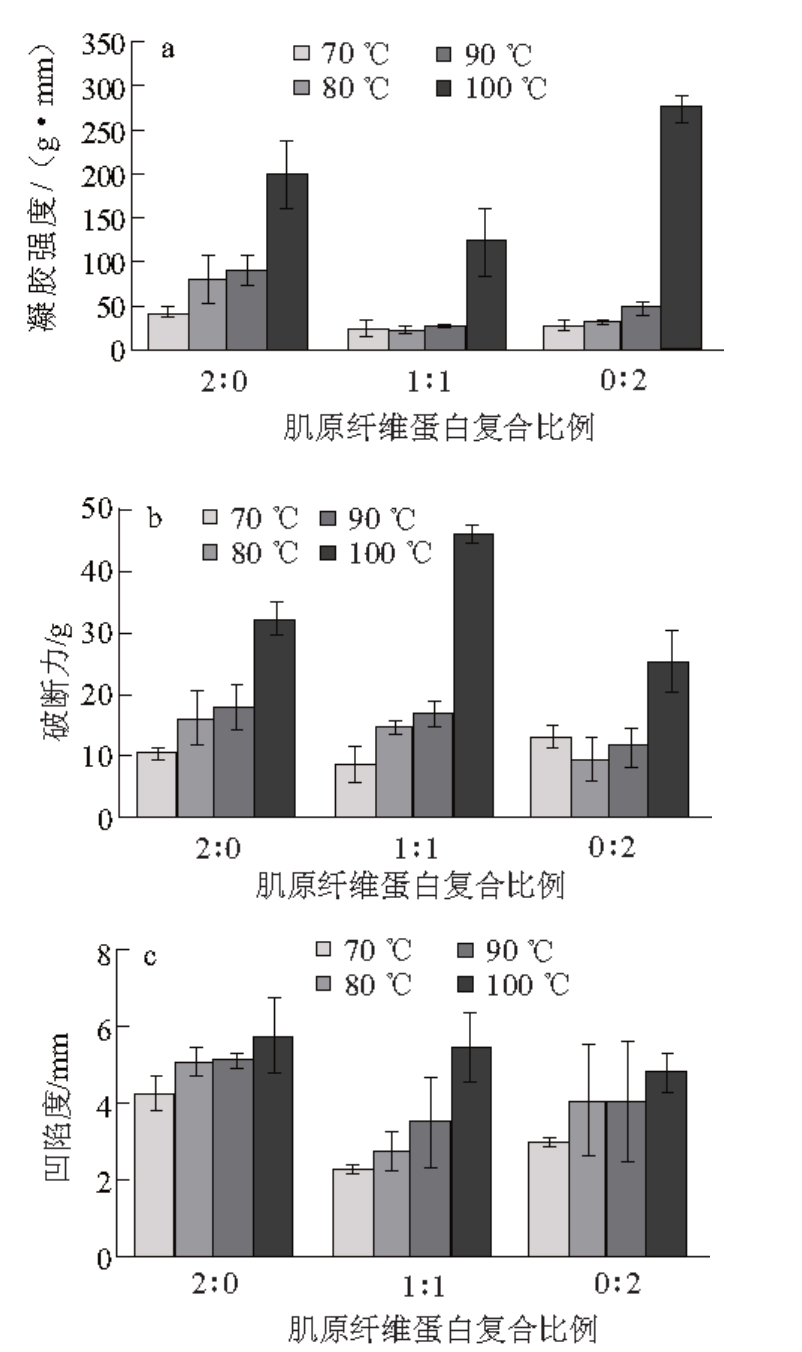
图 2 复合肌原纤维蛋白凝胶强度的变化
Fig. 2 Changes in gel strength of mixed myofibrillar proteins
由图2可知,猪肉和鱼肉肌原纤维蛋白凝胶强度随温度升高而显著增强(P<0.05),而复合肌原纤维蛋白凝胶强度仅在90~100 ℃时显著升高,在70~90 ℃变化不大;破断力均随温度升高而变大,但在70~90 ℃变化不显著,在90 ℃升至100 ℃时显著增大(P<0.05);猪肉和复合肌原纤维蛋白凝胶的凹陷度随温度升高而缓慢增加,鱼肉肌原纤维蛋白凝胶则在90~100 ℃时显著增大(P<0.05)。
凝胶强度与蛋白质的结构和功能变化有关 [5,11]。随着温度升高,蛋白质变性加剧,肌球蛋白之间交联增多,逐渐形成网状结构,使蛋白凝胶强度增强。此外,温度升高会使肌球蛋白疏水基团暴露,导致凝胶内部的水分分布发生改变,自由水含量降低,结合水含量升高,从而使凝胶强度增强 [12]。复合肌原纤维蛋白凝胶强度劣于单一肌原纤维蛋白凝胶,这表明猪肉和鱼肉肌原纤维蛋白之间可能出现了相互抑制,导致凝胶网络结构被破坏,单纯的肌原纤维蛋白复合可能很难起到改善凝胶强度的作用。但复合肌原纤维蛋白凝胶在70~90 ℃间凝胶强度变化不大,其对较低温度的敏感程度可能低于单一肌原纤维蛋白,这需要进一步研究。
2.3 复合肌原纤维蛋白凝胶质构特性的变化
表 1 复合肌原纤维蛋白凝胶质构特性的变化
Table 1 Changes in texture properties of mixed myofibrillar proteins
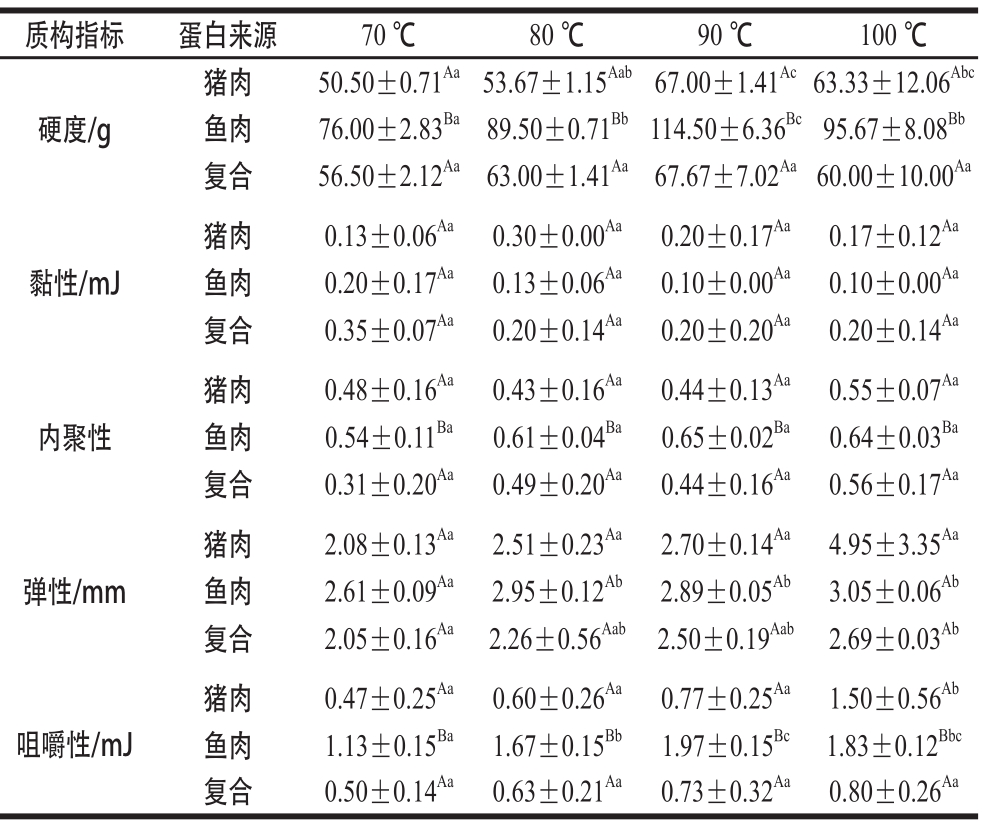
注:大写字母不同,表示不同蛋白凝胶之间具有显著差异(P<0.05);小写字母不同,表示不同温度之间具有显著差异(P<0.05)。
质构指标蛋白来源70 ℃80 ℃90 ℃100 ℃硬度/g猪肉50.50±0.71 Aa53.67±1.15 Aab67.00±1.41 Ac63.33±12.06 Abc鱼肉76.00±2.83 Ba89.50±0.71 Bb114.50±6.36 Bc95.67±8.08 Bb复合56.50±2.12 Aa63.00±1.41 Aa67.67±7.02 Aa60.00±10.00 Aa黏性/mJ猪肉0.13±0.06 Aa0.30±0.00 Aa0.20±0.17 Aa0.17±0.12 Aa鱼肉0.20±0.17 Aa0.13±0.06 Aa0.10±0.00 Aa0.10±0.00 Aa复合0.35±0.07 Aa0.20±0.14 Aa0.20±0.20 Aa0.20±0.14 Aa内聚性猪肉0.48±0.16 Aa0.43±0.16 Aa0.44±0.13 Aa0.55±0.07 Aa鱼肉0.54±0.11 Ba0.61±0.04 Ba0.65±0.02 Ba0.64±0.03 Ba复合0.31±0.20 Aa0.49±0.20 Aa0.44±0.16 Aa0.56±0.17 Aa弹性/mm猪肉2.08±0.13 Aa2.51±0.23 Aa2.70±0.14 Aa4.95±3.35 Aa鱼肉2.61±0.09 Aa2.95±0.12 Ab2.89±0.05 Ab3.05±0.06 Ab复合2.05±0.16 Aa2.26±0.56 Aab2.50±0.19 Aab2.69±0.03 Ab咀嚼性/mJ猪肉0.47±0.25 Aa0.60±0.26 Aa0.77±0.25 Aa1.50±0.56 Ab鱼肉1.13±0.15 Ba1.67±0.15 Bb1.97±0.15 Bc1.83±0.12 Bbc复合0.50±0.14 Aa0.63±0.21 Aa0.73±0.32 Aa0.80±0.26 Aa
由表1可知,3 种肌原纤维蛋白凝胶的硬度均随温度升高而先增大,在90 ℃达到最大后出现降低,且鱼肉蛋白凝胶的硬度与猪肉蛋白和复合蛋白凝胶显著不同(P<0.05),表明复合肌原纤维蛋白凝胶的硬度与猪肉蛋白更为接近。随着温度升高,蛋白质逐渐变性,维持蛋白质结构的氢键、疏水键等被破坏,二级结构、三级结构发生改变,蛋白凝胶中的水分流失,这是导致硬度增加的主要原因。但过高的温度又会导致蛋白质的分解,破坏蛋白质空间结构使其松散,造成硬度的下降,进而影响肉制品的口感和品质,因此加热温度不宜过高。
随着温度的升高,猪肉肌原纤维蛋白凝胶的黏性先增大后减小,在80 ℃达到最大,鱼肉和复合肌原纤维蛋白凝胶的黏性则呈现下降趋势,三者之间无明显差异(P>0.05)。据刘茹 [13]报道,鲢鱼肉和猪肉肌动蛋白的变性温度分别为71.7 ℃和76.8 ℃,猪肉蛋白的热稳定性要高于鲢鱼肉,因此这种差异可能导致了黏性变化的不同。温度升高可导致凝胶水分流失增多,凝胶结构收缩加剧,从而使黏性下降。复合肌原纤维蛋白凝胶的黏性略高于猪肉和鱼肉蛋白,表明2 种肌原纤维蛋白之间可能不是简单的混合,而是发生了相互作用,从而改变了黏性的变化规律。
内聚性是反映咀嚼时蛋白凝胶抵抗受损保证完整性能力大小的指标,咀嚼性则是硬度、弹性等综合作用的结果,是一项综合质地参数。鱼肉肌原纤维蛋白凝胶的内聚性和咀嚼性与猪肉、复合肌原纤维蛋白有显著差异(P<0.05),但3种肌原纤维蛋白凝胶的内聚性随温度升高并没有显著变化,而猪肉、鱼肉肌原纤维蛋白凝胶咀嚼性则随温度升高而显著变大(P<0.05)。内聚性、咀嚼性的变化主要受到肌球蛋白、肌动蛋白热变性的影响,同时也会受到水分迁移的影响 [10]。复合肌原纤维蛋白凝胶的内聚性和咀嚼性与猪肉肌原纤维蛋白凝胶更接近,但变化规律又不完全相同,说明复合肌原纤维蛋白凝胶中不同来源的肌原纤维蛋白之间可能发生了相互作用。
猪肉肌原纤维蛋白凝胶的弹性随温度升高没有显著变化(P>0.05),鱼肉肌原纤维蛋白凝胶的弹性在70~80 ℃显著升高,复合肌原纤维蛋白凝胶的弹性则在70~80 ℃和90~100 ℃显著变大(P<0.05)。随着温度升高,肌球蛋白、肌动蛋白逐渐变性,凝胶内部的水分发生迁移和流失,水分含量下降,导致3 种蛋白凝胶的弹性逐步增加。复合肌原纤维蛋白凝胶的弹性低于单一蛋白凝胶,说明猪肉和鱼肉肌原纤维蛋白之间可能发生了不利于弹性增强的反应。此外,Zhang等 [14]报道了水解小麦蛋白能够增强鱼糜质构特性,Wong等 [15]发现豌豆蛋白和乳清蛋白复合能够提升蛋白凝胶特性,这说明单纯的肌原纤维蛋白复合可能不足以改善蛋白凝胶质构,这有待进一步改进和研究。
2.4 加热温度对水分分布的影响
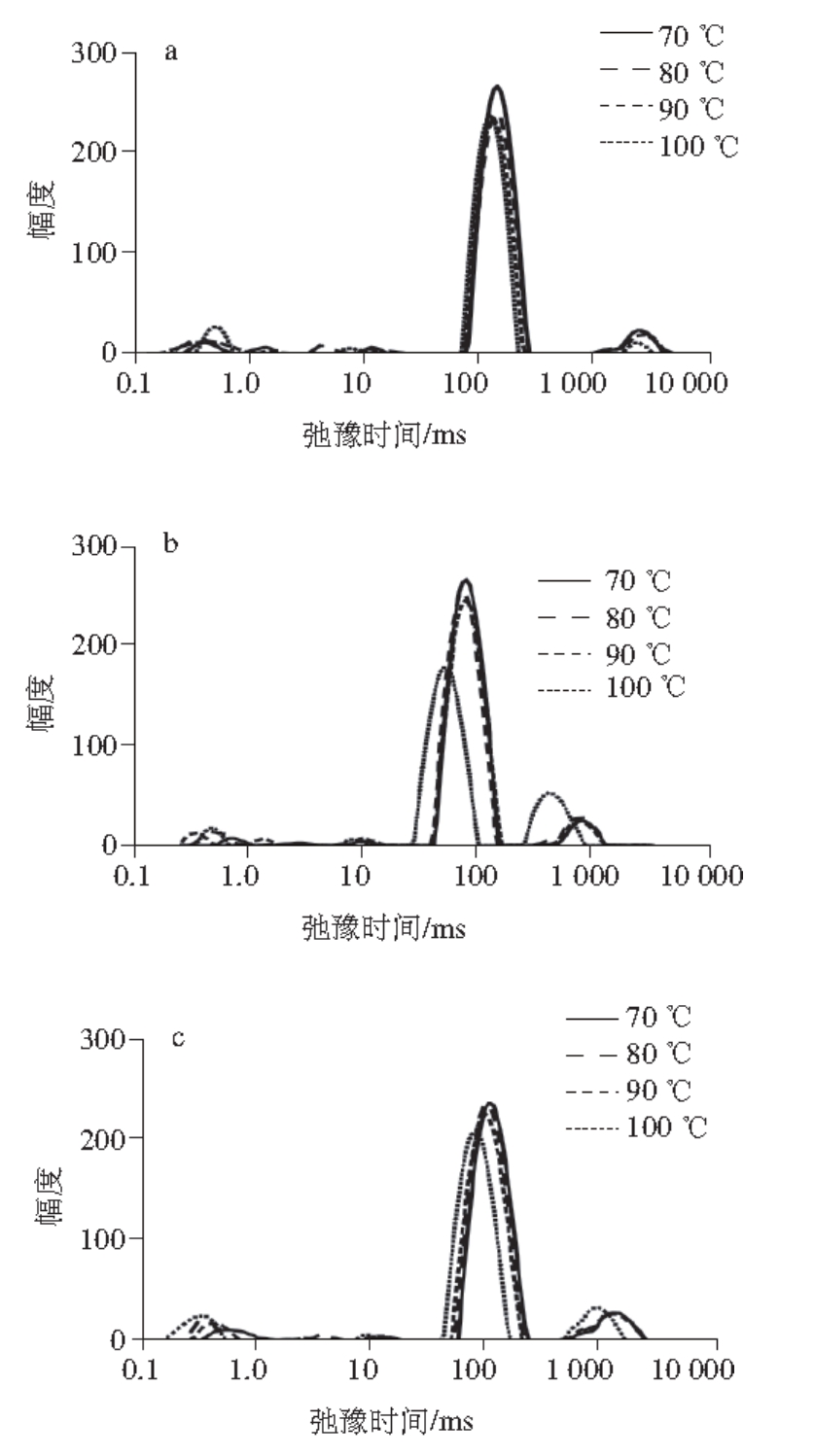
图 3 复合肌原纤维蛋白凝胶T
2弛豫时间的变化
Fig. 3 Changes in T
2relaxation time of mixed myofibrillar proteins
a.猪肉肌原纤维蛋白凝胶;b.鱼肉肌原纤维蛋白凝胶;c.复合肌原纤维蛋白凝胶。
由图3可知,肌原纤维蛋白凝胶的T 2弛豫时间在1~1 000 ms之间分布有3 个峰,依次表示凝胶中的结合水T 21、不易流动水T 22和自由水T 23 [16-18];峰面积代表不同组分水分的含量,分别记为P 21、P 22、P 23。随着加热温度的升高,3 种肌原纤维蛋白凝胶中结合水含量P 21升高,自由水含量P 23下降,且弛豫时间T 21逐渐变大,T 23逐渐变小。以上结果表明随着温度升高,蛋白质的结构和功能发生改变,从而使凝胶的结构及与水分结合的能力发生变化 [19-20],影响凝胶的凝胶强度、质构特性等,进而影响肉制品的品质 [21-22]。相关研究 [23]表明,结合水含量的增加有利于形成凝胶网络结构,改善凝胶性能。因此将加热温度控制在适宜范围有利于控制肉制品的水分含量,提高其品质。
虽然与猪肉、鱼肉肌原纤维蛋白凝胶水分分布的变化规律相似,但复合肌原纤维蛋白凝胶的弛豫时间T 2和水分含量P 2与前两者都不相同,这说明复合蛋白凝胶中不同来源的肌原纤维蛋白之间可能发生了相互作用,使蛋白质的结构和功能特性发生了变化,在结合单一蛋白特点的同时产生新的特性,这些变化与蛋白凝胶的质构特性密切相关。一些学者研究了不同来源蛋白质之间以及非蛋白成分与蛋白质之间的复合,证实了大豆蛋白 [11,24]、膳食纤维 [25]、谷氨酰胺转氨酶 [26-27]、NaCl [28]等能够通过改善水分分布来增强肌原纤维蛋白的凝胶特性,但关于不同来源肌原纤维蛋白之间复合的研究却较少,这也值得进一步研究。
随着加热温度的升高,猪肉、鱼肉、复合肌原纤维蛋白凝胶的色泽、凝胶强度、质构特性以及水分分布都发生了相应变化,肌原纤维蛋白凝胶的凝胶特性得到了一定程度的改善。肌原纤维蛋白凝胶特性随温度升高而增强,温度可通过影响蛋白质与水分的结合来影响蛋白质的凝胶特性,但温度过高会出现劣化,因此90 ℃是较为理想的加热温度。此外,1∶1复合的肌原纤维蛋白凝胶能够结合单一蛋白凝胶的特点,改善肌原纤维蛋白的凝胶特性,但肌原纤维蛋白之间的单纯复合可能不足以使蛋白凝胶特性获得综合改善和提升,还需进行更深入的研究。这将为复合肉制品和中低温肉制品的开发和研究,以及肉制品品质控制提供参考。
参考文献:
[1] 耿蕊. pH偏移结合温和热处理对大豆分离蛋白结构及功能性的影响及其与肌原纤维蛋白的互作[D]. 哈尔滨: 东北农业大学, 2015.
[2] TORNBERG E. Effects of heat on meat proteins: implications on structure and quality of meat products[J]. Meat Science, 2005, 70(3): 493-508. DOI:10.1016/j.meatsci.2004.11.021.
[3] 赵冰, 周慧敏, 张顺亮, 等. 中温杀菌对乳化香肠蛋白质变化的影响[J]. 肉类研究, 2016, 30(3): 5-9. DOI:10.15922/j.cnki. rlyj.2016.03.002.
[4] 姜启兴. 鳙鱼肉热加工特性及其机理研究[D]. 无锡: 江南大学, 2015.
[5] 刘蕾, 洪惠, 宋永令, 等. 不同加热条件对复合鱼糜凝胶特性的影响[J].肉类研究, 2010, 24(6): 15-18.
[6] 刘蕾, 王航, 罗永康, 等. 复合鱼肉肌原纤维蛋白加热过程中理化特性变化的研究[J]. 淡水渔业, 2012, 42(3): 88-91. DOI:10.3969/ j.issn.1000-6907.2012.03.018.
[7] 王卫芳. 鱼肉猪肉复合凝胶制品的开发及其影响因素的研究[D]. 武汉: 华中农业大学, 2006.
[8] HWANG J S, LAI K M, HSU K C. Changes in textural and rheological properties of gels from tilapia muscle proteins induced by high pressure and setting[J]. Food Chemistry, 2007, 104(2): 746-753. DOI:10.1016/j.foodchem.2006.11.075.
[9] AKAMITTATH J G, BREKKE C J, SCHANUS E G. Lipid oxidation and color stability in restructured meat systems during frozen storage[J]. Journal of Food Science, 1990, 55(6): 1513-1517. DOI:10.1111/j.1365-2621.1990.tb03557.x.
[10] 姜启兴, 申丽丽, 汤凤雨, 等. 加热温度对鳙鱼肉色泽和质构的影响研究[J]. 食品工业科技, 2013, 34(17): 67-70.
[11] 简华君. 大豆蛋白对肌纤维复合蛋白凝胶性质的影响[D]. 无锡: 江南大学, 2014.
[12] DEFREITAS Z, SEBRANEK J G, OLSON D G, et al. Carrageenan effects on salt- soluble meat proteins in model systems[J]. Journal of Food Science, 1997, 62: 539-543. DOI:10.1111/j.1365-2621.1997. tb04425.x.
[13] 刘茹. 鱼肉和猪肉凝胶的差异及其机制[D]. 武汉: 华中农业大学, 2008.
[14] ZHANG L, ZHANG F, WANG X. Effects of hydrolyzed wheat gluten on the properties of high-temperature (≥100 ℃) treated surimi gels[J]. Food Hydrocolloids, 2015, 45: 196-202. DOI:10.1016/ j.foodhyd.2014.11.016.
[15] WONG D, VASANTHAN T, OZIMRK L. Synergistic enhancement in the co-gelation of salt-soluble pea proteins and whey proteins[J]. Food Chemistry, 2013, 141(4): 3913-3919. DOI:10.1016/ j.foodchem.2013.05.082.
[16] GOETZ J, KOEHLER P. Study of the thermal denaturation of selected proteins of whey and egg by low resolution NMR[J]. LWTFood Science and Technology, 2005, 38(5): 501-512. DOI:10.1016/ j.lwt.2004.07.009.
[17] 李银, 李侠, 张春晖, 等. 利用低场核磁共振技术测定肌原纤维蛋白凝胶的保水性及其水分含量[J]. 现代食品科技, 2013(11): 2777-2781.
[18] 陈琳莉, 李侠, 张春晖, 等. 低场核磁共振法测定五种肉类中不同状态水分含量[J]. 分析科学学报, 2015, 31(1): 90-93. DOI:10.13526/ j.issn.1006-6144.2015.01.020.
[19] YANG H, ZHANG W, LI T, et al. Effect of protein structure on water and fat distribution during meat gelling[J]. Food Chemistry, 2016, 204: 239-245. DOI:10.1016/j.foodchem.2016.01.053.
[20] STANGIERSKI J, BARANOWSKA H M. The influence of heating and cooling process on the water binding in transglutaminase-modified chicken protein preparation, assessed using low-field NMR[J]. Food and Bioprocess Technology, 2015, 8(12): 2359-2367. DOI:10.1007/ s11947-015-1618-5.
[21] 夏天兰, 刘登勇, 徐幸莲, 等. 低场核磁共振技术在肉与肉制品水分测定及其相关品质特性中的应用[J]. 食品科学, 2011, 32(21): 253-256.
[22] 杨赫鸿, 李沛军, 孔保华, 等. 低场核磁共振技术在肉品科学研究中的应用[J]. 食品工业科技, 2012, 33(13): 400-405.
[23] 秦影, 汤海青, 欧昌荣, 等. 超高压处理对大黄鱼鱼糜水分状态和蛋白质结构的影响[J]. 农业工程学报, 2015(23): 246-252. DOI:10.11975/j.issn.1002-6819.2015.23.033.
[24] 杨芳, 潘思轶. 大豆蛋白凝胶复合体系水分状态的研究进展[J]. 食品科学, 2008, 29(10): 680-683.
[25] ZHUANG X, JIANG X, HAN M, et al. Influence of sugarcane dietary fiber on water states and microstructure of myofibrillar protein gels[J]. Food Hydrocolloids, 2016, 57: 253-261. DOI:10.1016/ j.foodhyd.2016.01.029.
[26] 李先保, 韩敏义, 费英, 等. 低场NMR法研究微生物转谷氨酰酶对猪肉肌原纤维蛋白凝胶功能特性的影响[J]. 南京农业大学学报, 2009, 32(3): 130-134. DOI:10.3321/j.issn:1000-2030.2009.03.024.
[27] 康建波, 李俊霞, 赵晶, 等. 猪肉鸡肉复合肌原纤维蛋白凝胶特性[J].农产品加工(学刊), 2012(8): 19-22. DOI:10.3969/j.issn.1671-9646(X).2012.08.005.
[28] 韩敏义, 刘永安, 王鹏, 等. 低场核磁共振法研究NaCl对肌原纤维蛋白凝胶水分分布和移动性的影响[J]. 食品科学, 2014, 35(21): 88-93. DOI:10.7506/spkx1002-6630-201421018.
Gel Properties of Mixed Myofibrillar Proteins
LI Qingzheng, FENG Ligeng, LUO Yongkang*
(College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Abstract:Temperature is one of the main factors affecting the gel properties of protein. This study researched the changes in color, gel strength, texture properties and water distribution during heat treatment of single and mixed samples of pork and silver carp myofibrillar proteins (MP) (pork MP:silver carp MP = 2:0, 1:1, 0:2, m/m) at 70, 80, 90 and 100 ℃ and explored the difference in gel properties and correlation between single and mixed myofibrillar proteins for the purpose of finding optimal heating temperature for protein gelation. Result indicated that the 1:1 mixture could combine the properties of pure protein gels, and improve gel properties of myofibrillar protein. Temperature could affect the gel properties of myofibrillar protein by influencing water distribution as demonstrated by low field nuclear magnetic resonance. With temperature rising, the gel properties of myofibrillar protein were enhanced, but it could be degraded at too high temperature. The optimal heating temperature was 90 ℃.
Key words:myofi brillar protein gel; mixed; pork; silver carp; gel properties; color; texture; water distribution
DOI:10.15922/j.cnki.rlyj.2016.12.001
中图分类号:TS251.1
文献标志码:A
文章编号:1001-8123(2016)12-0001-06
收稿日期:2016-06-09
基金项目:“十二五”国家科技支撑计划项目(2015BAD28B00);国家现代农业产业技术体系建设专项(CARS-46)
作者简介:李清正(1991—),男,硕士研究生,研究方向为水产品加工及贮藏。E-mail:haidaqingzheng@163.com
*通信作者:罗永康(1964—),男,教授,博士,研究方向为水产品加工及贮藏。E-mail:luoyongkang@263.net
引文格式:
李清正, 冯力更, 罗永康. 复合肌原纤维蛋白的凝胶特性[J]. 肉类研究, 2016, 30(12): 1-6. DOI:10.15922/j.cnki. rlyj.2016.12.001. http://rlyj.cbpt.cnki.net
LI Qingzheng, FENG Ligeng, LUO Yongkang. Gel properties of mixed myofibrillar proteins[J]. Meat Research, 2016, 30(12): 1-6. (in Chinese with English abstract)
DOI:10.15922/j.cnki.rlyj.2016.12.001. http://rlyj.cbpt.cnki.net