图1 某菜市场购买的调理肉制品的COⅠ基因片段PCR产物琼脂糖凝胶电泳图
Fig. 1 Agarose gel electrophoresis of CO Ⅰ gene PCR products from prepared meat collected from market
陈 健,岳巧云,邱德义*
(中山出入境检验检疫局检验检疫技术中心,广东 中山 528403)
摘 要:市场上出售的调理肉制品种类繁多,质量良莠不齐,产品与标签不符,掺假、以次充好等商业欺诈问题影响着人们的利益与健康。肉类食品掺假造假问题越来越受重视,但是由于来源肉类的形态特征已经被严重破坏或者肉味精等添加剂的使用,传统的检测方法无法快速、准确、便捷地完成此类产品成分的检测。本研究利用DNA条形码技术对3 个不同来源(超市、市场、火锅店)的36 份调理肉制品进行检测,结果表明:有27 份样品(75%)含有鸡源性成分,超市购买的调理肉制品中有2 份(10.5%)检出配料表未标出的肉类成分。本研究证明DNA条形码技术可作为调理肉制品的成分检测及溯源的高效检测方法。
关键词:调理肉制品;食品掺假;DNA条形码;快速检测;成分鉴定
引文格式:
陈健, 岳巧云, 邱德义. DNA条形码技术检测调理肉制品掺杂[J]. 肉类研究, 2016, 30(5): 35-39. DOI: 10.15922/j.cnki. rlyj.2016.05.008. http://rlyj.cbpt.cnki.net
CHEN Jian, YUE Qiaoyun, QIU Deyi. Application of DNA barcoding for the detection of adulterants in prepared meat products[J]. Meat Research, 2016, 30(4): 35-39. (in Chinese with English abstract) DOI: 10.15922/j.cnki.rlyj.2016.05.008. http://rlyj.cbpt.cnki.net
速食时代,越来越多的美味被“速冻”,且因其丰富多样的口味、快速便捷的烹饪方法而被现代人青睐 [1]。目前市场上的调理肉制品超过几百种,加工品种主要包括:鱼糜制品,如丸类和膏类;裹面制品,如裹面肉类、禽块等;乳化肉制品,如括丸类、脆脆肠等;烧烤烟熏制品,如烤熏肉、熏肠类产品 [2]。一些不法商贩受到利益的驱使,用淀粉、食品添加剂,少量甚至完全不添加主料的假冒商品来欺骗消费者。这类假冒伪劣产品不仅口感不佳,更有可能给广大消费者埋下健康隐患 [3]。目前国内对于其成分的研究甚少,仅曲勤凤等 [4]利用测定15 批次鱼糜制品(鱼丸),发现其中11 种鱼糜制品含量均<10%。但尚无对其他肉丸成分的研究报道。
对调理肉制品成分进行溯源不仅可以维护正常的经营秩序,保护消费者和生产者的安全并免受欺诈,同时也能保护一些动物物种免受过度或非法捕猎 [5]。但是传统上食品来源物种主要依靠生物的表型及解剖特征等进行鉴定。这类食品的物种的原始特征消失,这使得物种鉴别变得相对困难 [6]。近年来动物源性成分检测技术得到了快速发展,对于调理肉制品成分的鉴定,主要是从蛋白质与核酸水平进行。在蛋白质水平,常用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)、液相色谱、高效液相色谱等技术进行检测,这些方法共同的局限性在于对仪器、试剂和样品处理要求高,且检测加工样品时特异性和准确性较差,费时费力 [7-10]。从DNA水平进行的检测方法包括DNA探针杂交、聚合酶链式反应(polymerase chain reaction,PCR)、实时荧光PCR (real-time PCR)等 [3-6],但是也存在不足之处,需针对每种物种设计不同引物,且通用性差。
DNA条形码技术作为一种新兴的物种鉴定技术,与其他技术相比较,有着无可比拟的优势 [5]。它是一种灵敏、快速、廉价和可靠的方法,可识别和跟踪大量的原料和加工的食品类商品(即使是深度加工的食品),以及检测食品中的过敏原或有毒成分 [6,11-12]。目前,DNA条形码技术在渔类产品、禽畜肉类、可食用植物、加工食品鉴定中均有广泛地应用 [13-14]。它是一种应用生物本身所具有的、有足够变异的标准化短基因片段(细胞色素氧化酶Ⅰ,(cytochrome oxidase Ⅰ,CO Ⅰ)对物种进行快速、准确鉴定的生物身份识别技术 [15-17]。目前该技术在生物学各相关领域中也得到广泛应用 [18-23]。本研究尝试通过DNA条形码技术对市场上常见的调理肉制品的成分进行分析鉴定、溯源调查。
1.1 材料与试剂
从本地某菜市场、超市、火锅店分别采集调理肉制品样本36 份。
DNA提取试剂盒(目录号DP304)、琼脂糖凝胶回收试剂盒(目录号DP210)、克隆试剂盒(目录号VT202-02)、重组菌落鉴定试剂盒(目录号VI102)、dNTP、Loading buffer、DNA Marker II、SYBR Green I 等PCR试剂 天根生化科技(北京)有限公司;Ex-Taq DNA聚合酶 广州瑞真生物技术有限公司;引物由大连宝生物工程有限公司合成。
1.2 仪器与设备
ThermoPico 17微量台式离心机 美国Thermo Fisher公司;DYY-6C双稳定时电泳仪 北京科学深蓝科技有限公司;Veriti 96 ABIApplied Biosystems梯度PCR仪美国Applied Biosystems公司;MD-02N-220 Major Science金属浴 美国Major Science公司;Alliance 4.7 UVITEC凝胶成像仪 英国Uvitec公司。
1.3 方法
1.3.1 DNA提取
剪切、称取待测样品25 g,用去离子水将其表面洗净晾干后,用研磨棒将其研磨至粉末。取一小部分(约30 mg)置于1.5 mL离心管中,按照血液/细胞/组织基因组DNA提取试剂盒说明书指导提取基因组DNA。
1.3.2 DNA的扩增 [24]
1.3.2.1 引物
PCR扩增所用引物为:
LCO1490 5'-GGTCAACAAATCATAAAGATATTGG-3';
HCO2198 5'-TAAACTTCAGGGTGACCAAAAAATCA-3'。
1.3.2.2 扩增条件与反应体系
参考廖俊蕾等 [25]的方法。
Ex-Taq DNA聚合酶扩增条件:94 ℃变性5 min;94 ℃、30 s;50 ℃、30 s;72 ℃、1 min;30 个循环;72 ℃延伸10 min。
PCR反应体系(50 μL):10 倍PCR缓冲液5 μL;正向引物(20 nmol/μL)2 μL;反向引物(20 nmol/μL)2 μL;dNTP(10 μmol/μL)2 μL;Ex-Taq(5 U/μL)1 μL;模板DNA(50 ng/μL)3 μL;无菌水定容到50 μL。
1.3.3 DNA纯化
采用琼脂糖凝胶DNA回收试剂盒,按照试剂盒说明书对PCR产物进行纯化。
1.3.4 克隆
采用pGM-T连接试剂盒,按照试剂盒使用手册对纯化的PCR产物进行连接和转化,随机挑取白色菌落进行PCR检测,以确定克隆阳性。
1.3.5 测序和分析
每个样品随机挑选12 个阳性菌株送交上海立菲生物科技有限公司测序。测序结果进行蛋白质翻译校对无误后,在GenBank和BOLD中进行比对和相似度分析,并记录数据。
2.1 DNA条形码数据的获得及分析
3 个不同来源(超市、市场、火锅店)的36 份调理肉制品的DNA条形码(CO Ⅰ基因片段)片段PCR产物琼脂糖凝胶电泳结果如图1~3所示。

图1 某菜市场购买的调理肉制品的COⅠ基因片段PCR产物琼脂糖凝胶电泳图
Fig. 1 Agarose gel electrophoresis of CO Ⅰ gene PCR products from prepared meat collected from market

图2 某超市购买的调理肉制品的COⅠ基因片段PCR产物琼脂糖凝胶电泳图
Fig. 2 Agarose gel electrophoresis of CO Ⅰ gene PCR products from prepared meat collected from supermarket
图3 某火锅店调理肉制品的COⅠ基因片段PCR产物琼脂糖凝胶电泳图
Fig. 3 Agarose gel electrophoresis of CO Ⅰ gene PCR products from prepared meat collected from hotpot restaurant
由表1~3可知,所有样本的扩增产物均检测到1 条约658 bp的扩增片段,未见非特异性扩增产物。
将PCR产物经割胶纯化回收后进行连接和转化,随机挑取白色菌落进行PCR检测,检测结果如图4所示。
图4 单克隆菌落的蓝白斑PCR检测
Fig. 4 PCR detection of selected white monoclonal colonies
由图4可知,挑选的12 个白色菌落均扩增出目的条带,证明目的条带准确转化入大肠杆菌内,挑选这12 个阳性菌株扩大培养后送测序。
以品牌B的墨鱼丸的CO Ⅰ基因扩增序列为例,DNA测序结果经Mega 6.0软件验证图谱为有效序列,去掉两端的引物得到全长有效序列为658 bp。序列在GenBank 和BOLD中进行比对,结果显示,克隆后测出的序列与GenBank中公布的原鸡(登录号:gb|KF954727.1|)全线粒体序列中的细胞色素氧化酶亚基Ⅰ相似性为99.85%,仅有一对碱基差异。

图5 品牌B的墨鱼丸样品CO Ⅰ扩增序列经Genbank BLAST分析结果
Fig. 5 GenBank blast results of CO Ⅰ sequence from cuttlefish ball of Brand B
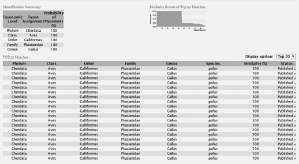
图6 获得的DNA条形码序列在BOLD中的比对结果
Fig. 6 Results of the DNA barcoding sequences matched in the BOLD
由图6可知,在BOLD中比对的结果为100%的原鸡,从而可确定这段DNA条形码序列为原鸡的序列。
2.2 某菜市场购买的调理肉制品成分鉴定
由表1可知,在某菜市场购买的12 种调理肉制品中共检测出6 种不同的成分,其中9 种(除鱼丸、鱼肠、墨鱼丸外)的成分仅为原鸡(Gallus gallus),并未检测出该名称食品相符的肉类成分。如:牛肉丸仅含有原鸡(Gallus gallus),但没有检测到牛源性成分。另外3 种鱼肉类调理肉制品——鱼肠、墨鱼丸、鱼丸的成分较为正常,除有鸡源性成分外还含有鱼肉成分。但是菜市场均为散装售卖方式,无法查其配料成分,从而无法确认鉴定结果与配料是否有出入。
表1 某菜市场购买的调理肉制品成分鉴定表
Table 1 Meat-derived components of prepared meat products collected from market
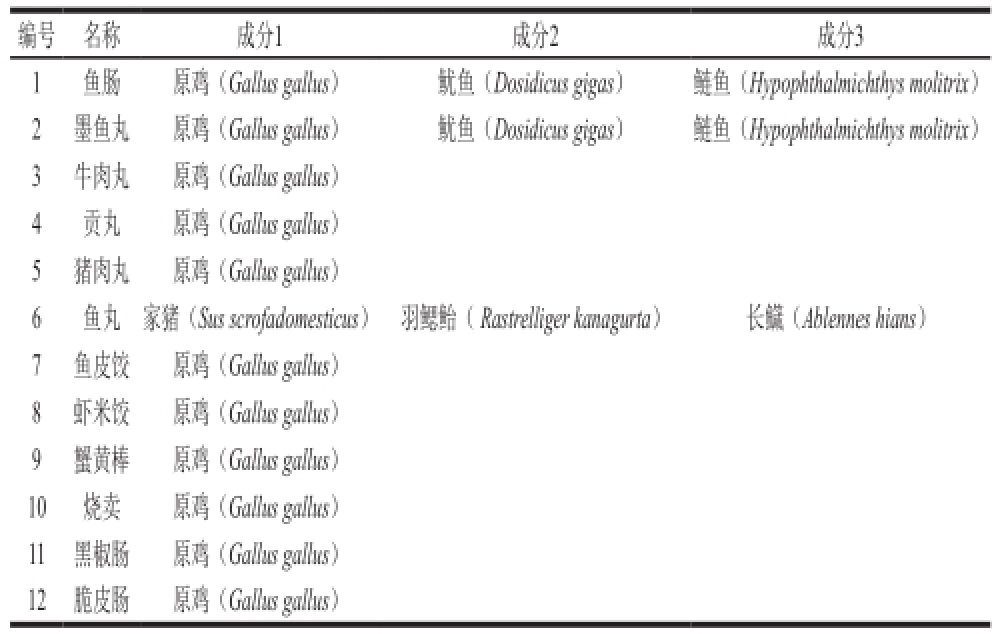
编号名称 成分1 成分2 成分3 1 鱼肠 原鸡(Gallus gallus) 鱿鱼(Dosidicus gigas) 鲢鱼(Hypophthalmichthys molitrix)2 墨鱼丸 原鸡(Gallus gallus) 鱿鱼(Dosidicus gigas) 鲢鱼(Hypophthalmichthys molitrix)3 牛肉丸 原鸡(Gallus gallus)4 贡丸 原鸡(Gallus gallus)5 猪肉丸 原鸡(Gallus gallus)6 鱼丸 家猪(Sus scrofadomesticus) 羽鳃鲐( Rastrelliger kanagurta) 长鱵(Ablennes hians)7 鱼皮饺 原鸡(Gallus gallus)8 虾米饺 原鸡(Gallus gallus)9 蟹黄棒 原鸡(Gallus gallus)10 烧卖 原鸡(Gallus gallus)11 黑椒肠 原鸡(Gallus gallus)12 脆皮肠 原鸡(Gallus gallus)
2.3 某超市购买的调理肉制品成分鉴定
表2 某超市购买的调理肉制品成分鉴定表
Table 2 Meat-derived components of prepared meat products collected from supermarket

品牌 名称 成分1 成分2 成分3 配料表中的肉类成分爆汁牛肉丸 原鸡(Gallus gallus)品牌A牛肉、猪肉、鸡肉撒尿牛肉丸 原鸡(Gallus gallus) 牛肉、猪肉、鸡肉虾味饺 原鸡(Gallus gallus) 猪肉、鸡肉、鱼糜鱼饺 原鸡(Gallus gallus) 墨鱼、猪肉、鱼糜经典墨鱼丸 原鸡(Gallus gallus) 鱿鱼(Dosidicus gigas) 墨鱼、鱼糜墨鱼胶 原鸡(Gallus gallus) 鱿鱼(Dosidicus gigas) 家猪(Sus scrofadomesticus) 墨鱼、鱼糜、猪肉、鸡肉墨鱼饺 原鸡(Gallus gallus) 墨鱼、鱼糜、猪肉墨鱼丸 原鸡(Gallus gallus) 鲢鱼(Hypophthalmichthys sp.) 墨鱼、鱼糜品牌B韩式章鱼丸 原鸡(Gallus gallus) 鱿鱼(Dosidicus gigas) 鱼、鱼糜、鸡肉、猪肉、鸭肉、章鱼、鱿鱼香港撒尿肉丸 原鸡(Gallus gallus) 家猪(Sus scrofadomesticus) 猪肉、鸡肉、鸭肉、鱼糜品牌C 香菇贡丸 原鸡(Gallus gallus) 猪肉、鸡肉品牌D牛肉、猪肉风味墨鱼丸 原鸡(Gallus gallus) 鱿鱼(Dosidicus gigas) 鲢鱼(Hypophthalmichthys molitrix)牛肉水饺 家猪(Sus scrofadomesticus)鱼糜、鸡肉、猪肉、章鱼、鱿鱼风味鱼豆腐 鲢鱼(Hypophthalmichthys molitrix)鱼糜品牌E 亲亲肠 原鸡(Gallus gallus) 鸡肉、猪肉撒尿肉丸 家猪(Sus scrofadomesticus) 牛肉、鸡肉、猪肉品牌F 精选肥羊卷 绵羊(Ovis aries) 羊肉品牌G经典撒尿牛肉丸 原鸡(Gallus gallus) 牛肉、猪肉、鸡肉品牌H 手打牛筋丸 家牛(Bos taurus) 牛肉、猪肉、鱼、甲壳纲肉类动物
由表2可知,在某超市购买的19 种8 个品牌的调理肉制品中,总共检测出6 种不同的成分,其中品牌A的5 种产品(经典墨鱼丸、墨鱼胶外)、品牌C的香菇贡丸、品牌E的亲亲肠、品牌G的经典撒尿牛肉丸共8 份样品仅检测出原鸡(Gallus gallus)成分,而这8 份样品的配料表中标示其他成分均未检出。品牌A的经典墨鱼丸和品牌B墨鱼丸产品的配料表标示含有墨鱼和鱼糜,但鉴定的成分分别为原鸡、鱿鱼(Dosidicus gigas)和原鸡、鲢鱼,可以肯定的是这2 个样品存在使用鸡肉掺假的行为。从该结果中可以看出,不管是菜市场低价出售的还是大品牌的调理肉制品,都存在使用鸡肉作为添加肉源的行为,对于鸡肉过敏症或有禁忌的人应避免进食该类食品。
2.4 某火锅店肉制食品成分鉴定
表3 某火锅店调理肉制品成分鉴定表
Table 3 Meat-derived components of prepared meat products collected from hotpot restaurant

名称 成分1 成分2 成分3鸡肉 原鸡(Gallus gallus)肥牛 家牛(Bos taurus)肥羊 绵羊(Ovis aries)牛肉丸 家牛(Bos taurus)羊肉丸 原鸡(Gallus gallus) 家牛(Bos taurus)绵羊(Ovis aries)
由表3可知,在某火锅店食用的肉制食品有5 种产品(3 种切片肉、2 种肉丸),共检测出3种不同的成分,其中鸡肉、肥牛、肥羊、牛肉丸名副其实,均检测出相应的成分。但是羊肉丸检测出的成分较复杂,含有原鸡(Gallus gallus)、家牛(Bos taurus)、绵羊(Ovis aries)3 种成分,不排除有掺假的可能。
调理肉制品因其原料高度破碎化,且添加诸多食品添加剂,传统的形态学方法已无法完成成分的鉴定 [6]。
本研究使用DNA条形码技术对3 类不同来源的36 份样品进行了检测,有27 份样品(75%)含有鸡源性成分,说明大部分厂家使用廉价鸡肉作为其他肉类的替代品,但大部分食品并没有进行显著的标示。因菜市场和火锅店的肉质食品为散装,无法查看配料表,实验仅能从成分与名称的对应关系来判断。具体情况分析如下:
1)某菜市场购买的散装调理肉制品质量最差,11 份样品(91.7%)中检测出鸡源性成分,9 个样品(75%)的检测出的成分与名称不相符。2)某火锅店提供的调理肉制品质量最好,采集的5 份样品检测出的成分均与名称相符,仅羊肉丸的成分较复杂,除了应有的羊肉成分外,还有鸡、牛源性成分,不排除有掺假的可能。3)某超市的调理肉制品鉴定后对照配料表,发现8 个样品(42.1%)检测的成分中仅含有鸡源性成分,却无配料表标示的其他成分,2 个样品(10.5%)中含有配料表中未标出的成分。
从本研究的结论中可以看出,目前市场上出售的调理肉制品质量参差不齐,尤其是利用价格低廉的鸡肉添加至其他种类的调理肉制品的现象较为严重。曲勤凤等 [4]利用实时荧光定量PCR法对市场上随机购买的15 批次鱼糜制品(鱼丸)进行检测,发现其中4 批次产品含量>10%,其他11 种鱼糜制品含量均<10%,与本研究结论相似,但其并未检测出其他成分。本研究成功地运用DNA条形码技术对调理肉制品的成分进行了定性检测,为检测调理肉制品类食品成分提供了新方法,且该方法灵敏、快速、廉价和可靠。对于维护广大消费者合法权益,稳定市场秩序,保障食品安全具有重要的意义。
DNA条形码技术是从分子水平上对食品进行鉴定,弥补了传统鉴定方法的不足,其准确、高效、简单的特点为食品鉴定领域带来了新的革命 [6]。但是DNA条形码鉴定技术只能定性的对食品成分进行检测,不能检测出每种成分的含量。因此,还需与荧光定量PCR等检测技术相结合进行进一步探索。
参考文献:
[1]蔡韬, 归志雯. 速冻调制食品, Hold住你生活[J]. 食品与生活,2012(3): 12-15.
[2]邓小顺. 速冻猪肉丸加工工艺及其添加剂的应用研究[D]. 南宁: 广西大学, 2013. DOI:10.7666/d.Y2408413.
[3]顾晓慧, 姚琳, 王联珠, 等. 冷冻鱼糜中植物成分的PCR检测方法[J].中国渔业质量与标准, 2014, 4(2): 44-49.
[4]曲勤凤, 黄青山, 段文锋, 等. 鱼糜制品中主料含量的实时荧光定量PCR法测定[J]. 食品工业, 2011(11): 114-116.
[5]李敏, 凌超, 邬琦沁, 等. DNA条形码技术在食品溯源中的应用[J].乳业科学与技术, 2014, 37(5): 25-30.
[6]吕冬梅, 黄原, 文慧, 等. DNA条形码技术在食品鉴定中的应用[J].食品科学, 2015, 36(9): 248-252.
[7]von HOLST C, HONIKEL K O, UNGLAUB W, et al. Determination of an appropriate heat treatment of animal waste using the ELISA technique: result of a validation survey[J]. Meat Science, 2000, 54(1):1-7. DOI: 10.1016/S0309-1740(99)00087-X.
[8]王小燕, 王锡昌, 刘源, 等. 近红外光谱技术在食品掺伪检测应用中的研究进展[J]. 食品科学, 2011, 32(1): 265-269.
[9]van RAAMSDONK L, von HOLST C, BAETEN V, et al. New developments in the detection and identification of processed animal proteins in feeds[J]. Animal Feed Science and Technology, 2007,133(1): 63-83. DOI:10.1016/j.anifeedsci.2006.08.004.
[10]SCHONHERR J. Analysis of products of animal origin in feeds by detection of carnosine and related dipeptides by high-performance liquid chromatography[J]. Journal of Agricultural and Food Chemistry,2002, 50(7): 1945-1950. DOI:10.1021/jf0112116.
[11]ASLAN Ö, HAMILL R M, SWEENEY T, et al. Integrity of nuclear genomic deoxyribonucleic acid in cooked meat: implications for food traceability[J]. Journal of Animal Science, 2009, 87(1): 57-61. DOI:10.2527/jas.2008-0995 .
[12]SMITH P J, MCVEAGH S M, SSTEINKE D. DNA barcoding for the identification of smoked fish products[J]. Journal of Fish Biology,2008, 72(2): 464-471. DOI:10.1111/j.1095-8649.2007.01745.x.
[13]CHEN Jian, QIU Deyi, YUE Qiaoyun, et al. A successful case of DNA barcoding used in an international trade dispute[J]. DNA Barcodes,2014, 2: 21-28. DOI:10.2478/dna-2014-0004.
[14]YUE Qiaoyun, Chen Jian. Successful use of DNA barcoding in international trade dispute[J]. Barcode Bulletin, 2014, 5(4): 12-13.
[15]HEBERT P D, CYWINSKA A, BALL S L, et al. Biological identifications through DNA barcodes[J]. Proceedings of the Royal Society of London, Series B: Biological Sciences, 2003, 270: 313-321. DOI:10.1098/rspb.2002.2218.
[16]HEBERT P D, RATNASINGHAM S, DEWAARD J R. Barcoding animal life: cytochrome c oxidase subunit 1 divergences among closely related species[J]. Proceedings of the Royal Society B Biological Sciences, 2003, 270: S96-S99. DOI:10.1098/rsbl.2003.0025.
[17]BALL S L, HEBERT P D N, BURIAN S K, et al. Biological identification of mayflies (Ephemeroptera) using DNA barcodes[J]. Journal of the North American Benthological Society, 2005, 24(3):508-524. DOI:10.1899/04-142.1.
[18]程希婷, 王爱民, 顾志峰, 等. DNA条形码研究进展[J]. 基因组学与应用生物学, 2012, 30(6): 748-758. DOI:10.3969/gab.030.000748.
[19]刘德星, 聂维忠, 邱德义, 等. 应用DNA条形码技术快速鉴定入境船舶上截获的昆虫蛹[J]. 检验检疫学刊, 2014(5): 53-57. DOI:10.3969/ j.issn.1674-5354.2014.05.018.
[20]岳巧云, 邱德义, 黄艺文, 等. 应用DNA条形码技术鉴定未知双翅目蛹[J]. 中国国境卫生检疫杂志, 2011, 34(5): 343-347.
[21]岳巧云, 邱德义, 黄艺文, 等. DNA条形码技术在未知昆虫幼虫种类鉴定中的应用[J]. 中国卫生检验杂志, 2011(3): 615-617.
[22]YUE Qiaoyun, WU Keliang, QIU Deyi, et al. A formal re-description of the cockroach hebardina concinna anchored on DNA barcodes confirms wing polymorphism and identifies morphological characters for field identification[J]. PLoS One, 2014, 9: e106789-e106789 . DOI:10.1371/journal.pone.0106789.
[23]邱德义, 胡佳, 刘德星, 等. DNA条形码技术在肉品防欺诈鉴别中的应用[J]. 肉类研究, 2013, 27(4): 40-43.
[24]李新光, 王璐, 赵峰, 等. DNA条形码技术在鱼肉及其制品鉴别中的应用[J]. 食品科学, 2013, 34(18): 337-342.
[25]廖俊蕾, 岳巧云, 邱德义, 等. 新截获中国未见分布种杜比亚丽蝇形态和DNA条形码鉴定[J]. 中国媒介生物学及控制杂志, 2014, 25(6):509-513. DOI:10.11853/j.issn.1003.4692.2014.06.006.
Application of DNA Barcoding for the Detection of Adulterants in Prepared Meat Products
CHEN Jian, YUE Qiaoyun, QIU Deyi*
(Inspection and Quaratine Techenology Center, Zhongshan Entry-Exit Inspection and Quaratine Bureau, Zhongshan 528403, China)
Abstract:Although there are diverse types of prepared meat products on the market, their uneven quality and mislabeling as well as commercial fraud such as adulteration and passing an inferior product off as a superior one have a negative impact on consumer health and interests. Adulteration and counterfeiting of prepared meat products is gaining more and more attention,which, however, could not be rapidly, accurately and conveniently detected using traditional detection methods because of either serious destruction of the morphology of the raw meat during processing or the use of meat essence in prepared meat products. In this study, we used DNA barcoding to detect whether 36 prepared meat samples collected from three different sources (supermarket, market and hotpot restaurant) were adulterated. The results showed that 27 samples (75%) contained chicken-derived ingredients. Unlabeled ingredients were detected from two (10.5%) of the supermarket samples. This study demonstrates that DNA barcoding is an effcient method for detecting components of prepared meat products.
Key words:prepared meat products; food adulteration; DNA barcoding; rapid detection; composition identifcation
DOI:10.15922/j.cnki.rlyj.2016.05.008
中图分类号:Q95
文献标志码:A
文章编号:1001-8123(2016)06-0035-05
收稿日期:2016-01-07
基金项目:中山市科技计划项目(2013A3FC0248;2014A2FC249)
作者简介:陈健(1987—),男,硕士研究生,研究方向为食品和卫生检疫。E-mail:chenjian5861111@163.com
*
通信作者:邱德义(1969—),男,高级工程师,博士,研究方向为食品化妆品检验检疫。E-mail:qiudy@zs.gdciq.gov.cn