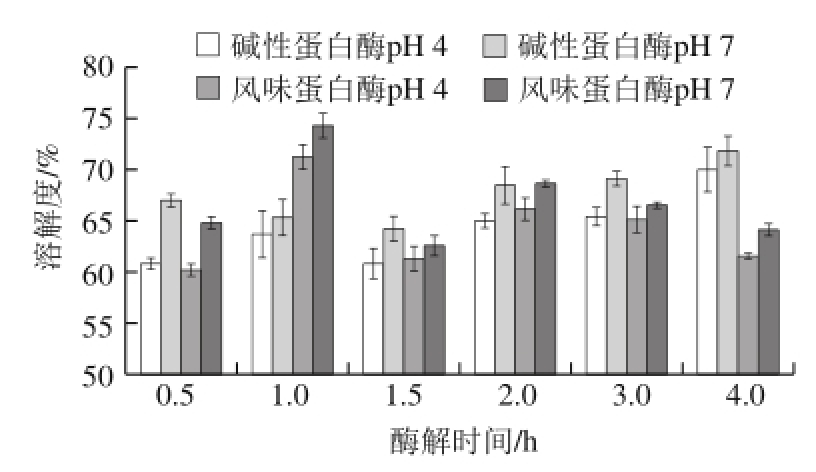
图1 鳙鱼鱼肉蛋白酶解产物在pH 4和pH 7条件下的溶解度
Fig. 1 Solubility of A. nobilis protein hydrolysates prepared by using Alcalase and Flavourzyme
『基础研究』Basic Research
李东萍
1,张 展
1,郭珊珊
2,罗永康
1,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.山东翰龙生物科技有限公司,山东 滨州 256600)
摘 要:为了研究酶解时间、pH值及酶解产物分子质量大小对鳙鱼(Aristichthys nobilis)鱼肉蛋白酶解产物加工特性及抗氧化性的影响,本研究采用碱性蛋白酶和风味蛋白酶对鳙鱼鱼肉进行酶解,对其酶解产物进行加工特性和抗氧化性分析。结果表明:2 种蛋白酶酶解产物在pH 4条件下的溶解性和热稳定性均低于pH 7。其中,碱性蛋白酶和风味蛋白酶酶解产物分别在酶解4.0 h和1.0 h具有较优的溶解性及热稳定性。碱性蛋白酶酶解产物具有较优的亚铁离子螯合能力,而乳化性、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率及还原力则是风味蛋白酶酶解产物更优。酶解产物的加工特性及抗氧化性受蛋白酶种类、酶解时间、pH值及酶解产物分子质量大小的影响。
关键词:鳙鱼;鱼肉;酶解产物;加工特性;抗氧化性
引文格式:
李东萍,张展,郭珊珊,等.鳙鱼鱼肉不同酶解产物的加工特性及抗氧化性[J].肉类研究,2016,30(6):1-5. DOI:10.15922/j.cnki.rlyj.2016.06.001. http://rlyj.cbpt.cnki.net
LI Dongping, ZHANG Zhan, GUO Shanshan, et al. Processing properties and antioxidant activity of protein hydrolysates from bighead carp (Aristichthys nobilis) meat produced with two different proteases[J]. Meat Research, 2016, 30(6): 1-5. (in Chinese with English abstract) DOI: 10.15922/j.cnki.rlyj.2016.06.001. http://rlyj.cbpt.cnki.net
鳙鱼(Aristichthys nobilis)又叫花鲢、胖头鱼,是中国四大家鱼之一,分布范围较广,具有较高的营养价值及经济价值 [1],但由于其肉质口感较差,土腥味严重,而且消费者更喜食鳙鱼头的一系列原因,造成了鳙鱼鱼身销量不佳的现状。因此,对鳙鱼肉进行再加工,提高其附加值是目前亟待解决的问题。动植物蛋白多肽链内部普遍存在着功能区,功能区中所蕴藏的生物活性肽在母体的蛋白质序列内不具生物活性,但是通过蛋白酶酶解后即可发挥特定的功能 [2]。因此,近年来通过制备动植物蛋白酶解产物进而提高产品的营养价值和商业价值已然成为热点 [3-5]。
目前,国内外对于利用生物酶解技术开发食源性生物活性肽已有大量报道 [6-11],对蛋白酶解产物功能的研究也有一定报道,主要包括加工特性(溶解性、热稳定性及乳化性等)及抗氧化性((1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率、亚铁离子螯合能力及总还原力等) [12-16]。但对鳙鱼蛋白酶解产物的加工特性及抗氧化性尚未进行系统研究。因此,本实验采用碱性蛋白酶和风味蛋白酶分别酶解鳙鱼鱼肉,对其酶解产物的加工特性及抗氧化性进行研究,以期为鱼肉蛋白的开发利用提供一定的参考。
1.1 材料与试剂
鳙鱼购于北京市小月河农贸市场(质量(1 390±200)g,体长(44±1)cm)。活体运至实验室后敲击头部致死,迅速去鳞、头、内脏、骨,洗净后取肉(白肉),用高速匀浆机搅成肉糜。
碱性蛋白酶 北京奥博星生物技术有限责任公司;风味蛋白酶 广西南宁庞博生物工程有限公司;三硝基苯磺酸(trinitrobenzenesulfonic acid sol,TNBS)、DPPH、啡咯嗪 美国Sigma公司;其他试剂均为化学分析纯。
1.2 仪器与设备
UNICO-2700分光光度计 美国Unic公司;FE20梅特勒-托利多实验室pH计 梅特勒-托利多仪器(上海)有限公司;FD-1PF冷冻干燥机 北京德天佑科技发展有限公司;TGL-16A台式高速冷冻离心机 上海安亭科技仪器厂;LM-125中空纤维超滤设备 北京旭邦膜设备有限责任公司。
1.3 方法
1.3.1 鳙鱼鱼肉蛋白酶解产物的制备
鳙鱼鱼糜+去离子水→混合调整蛋白质质量浓度至5 g/100 mL→95 ℃水浴10 min(灭内源性蛋白酶)→匀浆→分别添加碱性蛋白酶(pH 8.0,55 ℃)、风味蛋白酶(pH 7.0,50 ℃)→分别酶解0.5、1.0、1.5、2.0、3.0、4.0 h→95 ℃水浴10 min(灭酶)→3 600 r/min离心20 min→取上清液
处理1:上清液直接-60 ℃冷冻干燥;处理2:上清液→5 kD超滤分离→透过液3 kD超滤分离→各区分物浓缩→-60 ℃冷冻干燥
1.3.2 酶解产物加工特性的测定
溶解度的测定参考李雪等 [17]的方法并稍作修改,酶解溶液pH值分别调节到4和7。热稳定性的测定参考Fujiwara等 [18]的方法并稍作修改,酶解溶液pH值分别调节到4和7。乳化性的测定参考Pearce等 [19]的方法。
1.3.3 酶解产物抗氧化性的测定
DPPH自由基清除能力测定参考Bougatef等 [20]的方法。亚铁离子螯合力的测定参考Decker等 [21]的方法。总还原力的测定参考Yildirim等 [22]的方法。
2.1 鳙鱼鱼肉蛋白酶解产物的加工特性
2.1.1 鳙鱼鱼肉蛋白酶解产物溶解性

图1 鳙鱼鱼肉蛋白酶解产物在pH 4和pH 7条件下的溶解度
Fig. 1 Solubility of A. nobilis protein hydrolysates prepared by using Alcalase and Flavourzyme
由图1可知,经碱性蛋白酶及风味蛋白酶处理的鳙鱼鱼肉蛋白酶解产物在pH 4和pH 7两种条件下具有较好的溶解性,均高于60%。2 种蛋白酶解产物的溶解性在pH 7条件下较pH 4条件下高,即酶解产物在酸性条件下溶解性较小。李雪等 [23]得到了相似的研究结果,经碱性蛋白酶酶解鲽鱼下脚料的酶解产物的溶解性在pH 7时较pH 4时高。此外,这一结果也与鳕鱼、鲅鱼等的研究结果类似 [24]。在pH 7条件下碱性蛋白酶酶解4.0 h的酶解产物溶解度最高,达到71.82%。在pH 7条件下风味蛋白酶酶解1.0 h的酶解产物溶解度最高,达到74.29%。
2.1.2 鳙鱼鱼肉蛋白酶解产物热稳定性
由图2可知,经碱性蛋白酶及风味蛋白酶处理的鳙鱼鱼肉蛋白酶解产物在pH 7条件下的热稳定性均较pH 4条件下的高。风味蛋白酶酶解产物的热稳定性在酶解1.0 h为最高,达到72.31%(pH 4)和74.00%(pH 7)。而碱性蛋白酶酶解产物的热稳定性在酶解4.0 h为最高,达到72.98%(pH 4)和75.12%(pH 7)。热稳定性的研究结果同溶解性的结果有较好的一致性。
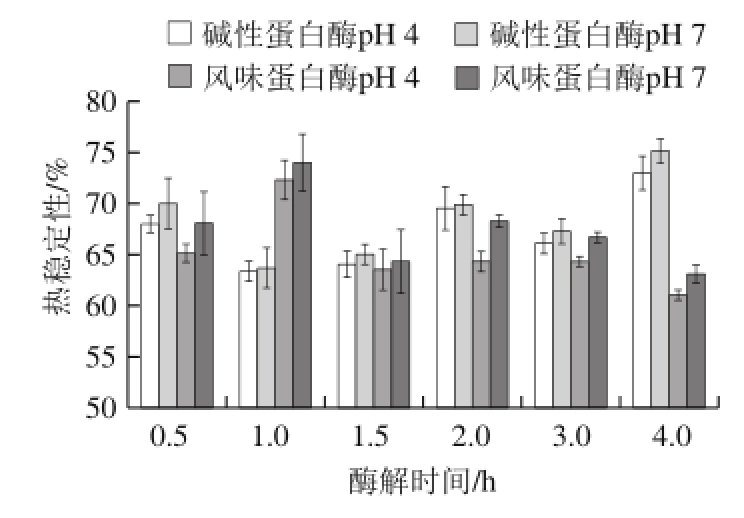
图2 鳙鱼鱼肉蛋白酶解产物在pH 4和pH 7条件下的热稳定性
Fig. 2 Thermal stability of A. nobilis protein hydrolysates prepared by using Alcalase and Flavourzyme
2.1.3 鳙鱼鱼肉蛋白酶解产物乳化性
蛋白质分子的乳化性主要受其分子质量、疏水基团数量、弹性及分子结构所影响。一定程度的酶解可以使蛋白质溶解度增大,从而使鱼肉蛋白的乳化性得到有效提高,但如果酶解过度,小分子肽及氨基酸的含量增加过大,反而不利于乳化性的提高 [25-26]。
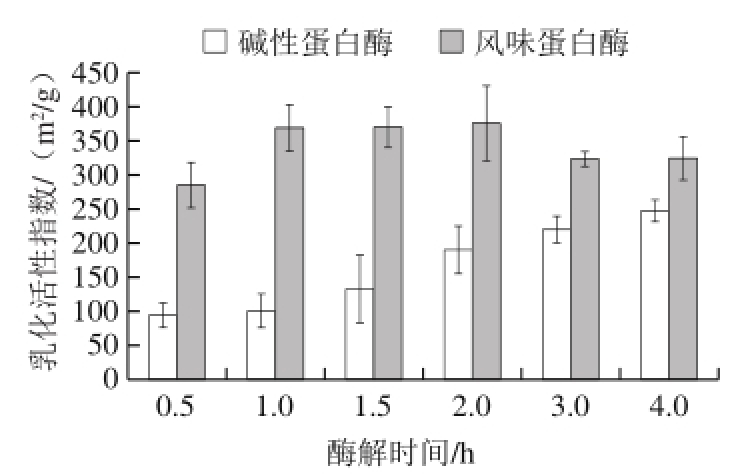
图3 酶解时间对鳙鱼鱼肉蛋白酶解产物乳化性的影响
Fig. 3 Emulsifying activity indexes of A. nobilis protein hydrolysates prepared by using Alcalase and Flavourzyme at different time points
由图3可知,随着酶解时间的延长,碱性蛋白酶酶解产物的乳化活性指数逐渐升高,酶解4.0 h时达到247.50 m 2/g。风味蛋白酶酶解产物的乳化活性指数在前1.0 h酶解时,逐渐升高,酶解1.0 h时达到369.09 m 2/g,之后稍有降低。
2.2 鳙鱼鱼肉蛋白酶解产物的抗氧化性
2.2.1 鳙鱼鱼肉蛋白酶解产物亚铁离子螯合能力
由图4a可知,经碱性蛋白酶和风味蛋白酶酶解的鳙鱼鱼肉蛋白酶解产物均具有较强的亚铁离子螯合能力。这可能是酶解过程中,蛋白质分子内部暴露出的羧基以及在氨基酸侧链中存在的酸性和碱性氨基酸残基的原因 [27]。在不同酶解时间条件下,碱性蛋白酶酶解产物的亚铁离子螯合力均显著高于风味蛋白酶酶解产物(P<0.05)。酶解0.5 h的碱性蛋白酶酶解产物的亚铁离子螯合力最高,为89.59%,之后随着酶解时间的延长逐渐降低,而风味蛋白酶则呈现波动变化,且在整个酶解过程中不存在显著性差异(P>0.05)。图4b为超滤所得的不同分子质量的酶解产物的亚铁离子螯合能力的差异,分子质量小于3 kD的酶解产物的亚铁离子螯合能力显著高于高分子质量的酶解产物,且碱性蛋白酶酶解产物亚铁离子螯合能力较风味蛋白酶酶解产物高,这与图4a保持了较好的一致性。此外有研究表明,菜豆碱性蛋白酶酶解产物 [28]及草鱼鱼肉木瓜蛋白酶酶解产物 [29]均具有较强的亚铁离子螯合能力。
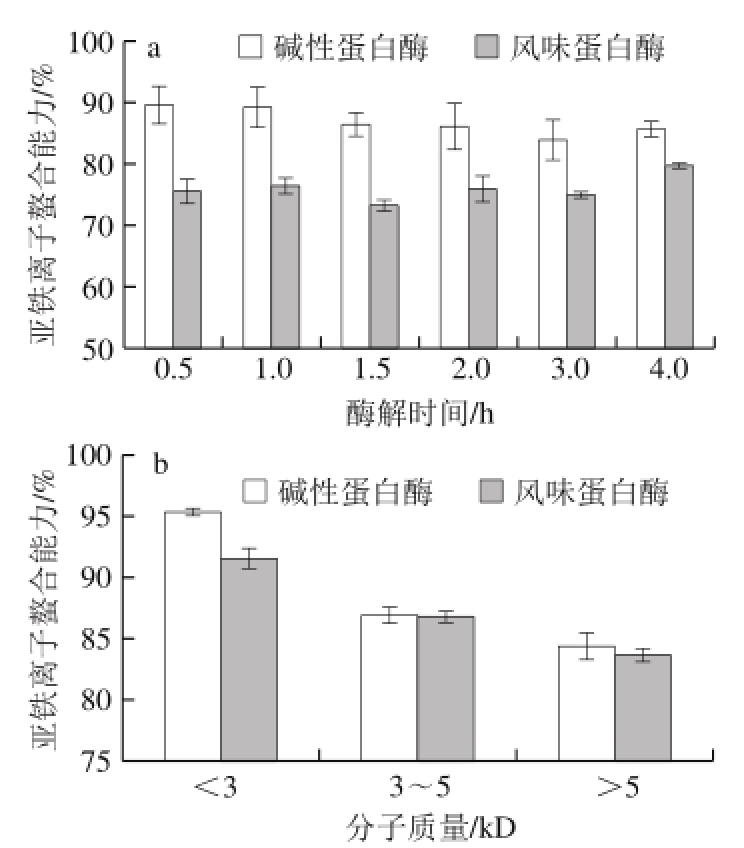
图4 酶解时间(a)和酶解产物分子质量(b)对鳙鱼鱼肉蛋白酶解产物亚铁离子螯合能力的影响
Fig. 4 Metal chelating activity of A. nobilis protein hydrolysates prepared by using Alcalase and Flavourzyme at different time points (a)and with different molecular weights (b)
2.2.2 鳙鱼鱼肉蛋白酶解产物DPPH自由基清除率
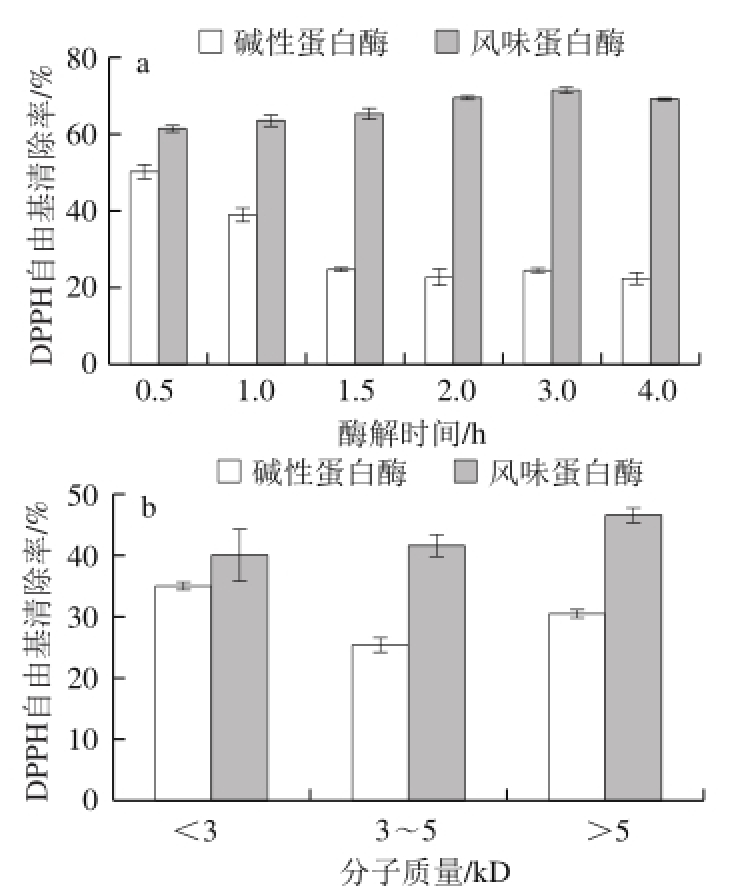
图5 酶解时间(a)和酶解产物分子质量(b)对鳙鱼鱼肉蛋白酶解产物DPPH自由基清除率的影响
Fig. 5 DPPH radical scavenging capacities of A. nobilis protein hydrolysates prepared by using Alcalase and Flavourzyme at different time points (a) and with different molecular weights (b)
DPPH自由基清除能力,指酶解产物能够抑制脂质过氧化反应,并起到降低羟自由基、烷自由基或过氧化自由基的浓度的作用 [30]。由图5a可知,酶解0.5 h的碱性蛋白酶酶解产物的DPPH自由基清除率最高,为50.23%。在0.5~1.5 h,碱性蛋白酶DPPH自由基清除率逐渐降低,随后至4.0 h,趋于平缓。而风味蛋白酶酶解产物的DPPH自由基清除率则缓慢升高至2.0 h后趋于平缓,酶解3.0 h时达到最高为71.48%。不同酶解时间条件下,风味蛋白酶酶解产物的DPPH自由基清除率均显著高于碱性蛋白酶酶解产物(P<0.05)。由图5b可知,实验中3 种分子质量酶解产物的DPPH自由基清除率差异不大,但风味蛋白酶酶解产物显著高于碱性蛋白酶酶解产物(P<0.05),这与图5a的结果相一致。有研究表明,酶解产物中疏水性氨基酸的含量影响酶解产物DPPH自由基清除率,疏水性氨基酸含量越高,DPPH自由基清除率越强 [31]。因此推测,2 种酶解产物的DPPH自由基清除率有所差异是由于酶解体系及酶解产物中疏水性氨基酸含量不同。
2.2.3 鳙鱼鱼肉蛋白酶解产物还原力
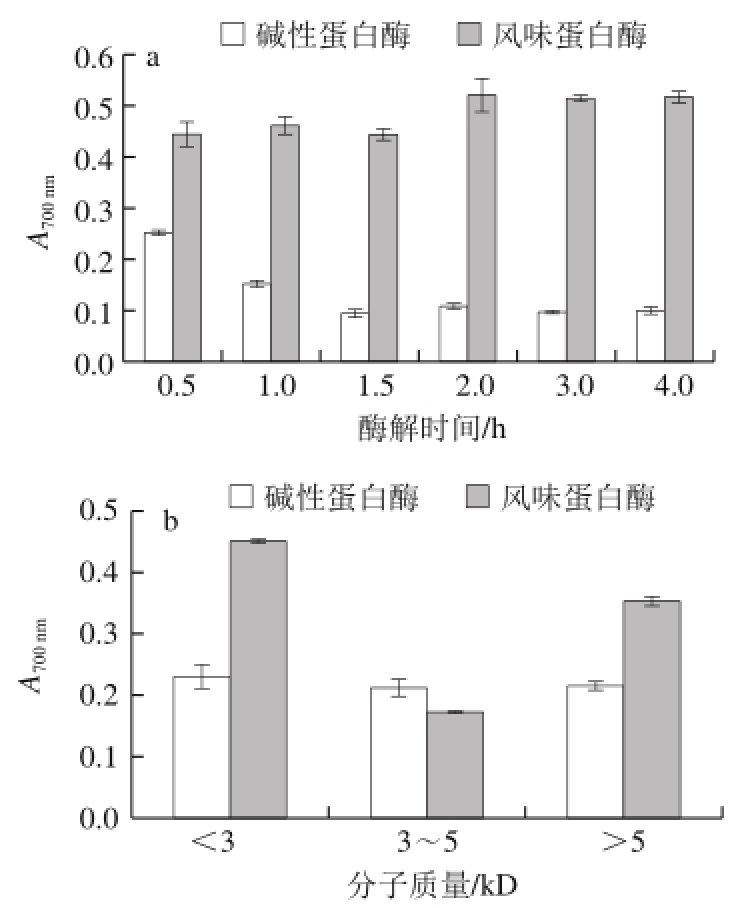
图6 酶解时间(a)和酶解产物分子质量(b)对鳙鱼鱼肉蛋白酶解产物还原力的影响
Fig. 6 Reducing power of A. nobilis protein hydrolysates prepared by using Alcalase and Flavourzyme at different time points (a) and with different molecular weights (b)
由图6a可知,2 种酶解产物均具有一定的还原力。同DPPH自由基清除率结果相似,随着酶解时间延长,碱性蛋白酶酶解产物的还原力逐渐降低后趋于平缓;酶解0.5 h时,还原力最高。风味蛋白酶酶解产物的还原力显著高于碱性蛋白酶酶解产物(P<0.05),但同酶解时间关系不大。由图6b可知,不同分子质量大小的碱性蛋白酶酶解产物的还原力差异不大,而分子质量小于3 kD的风味蛋白酶酶解产物具有较优的还原力。
酶解时间、蛋白酶种类以及酶解产物分子质量大小是鳙鱼鱼肉蛋白酶解产物的加工特性和抗氧化性的影响因素。碱性蛋白酶及风味蛋白酶酶解产物的溶解性及热稳定性分别在酶解4.0 h及酶解1.0 h时最优,2 种酶解产物pH 7条件下的溶解性和热稳定性均较pH 4条件下更好。风味蛋白酶酶解产物的乳化性优于碱性蛋白酶酶解产物的乳化性。
鳙鱼鱼肉碱性蛋白酶酶解产物具有较优的亚铁离子螯合能力,而风味蛋白酶酶解产物具有更好的DPPH自由基清除率及还原力。分子质量<3 kD的鳙鱼鱼肉蛋白酶解产物的亚铁离子螯合能力显著高于高分子质量的酶解产物,而不同分子质量的酶解产物的DPPH自由基清除率差异不大。还需进一步的实验验证2 种蛋白酶酶解产物的加工特性及抗氧化性,例如将2 种蛋白酶酶解产物加入鱼糜中,通过测定过氧化物值、共轭二烯值等进行验证。此外,不同蛋白酶的添加、蛋白酶之间的复配添加对酶解产物加工特性及抗氧化性的影响有待研究。
参考文献:
[1]姜启兴,吴佳芮,许艳顺,等.鳙鱼不同部位的成分分析及营养评价[J].食品科学,2014,35(5):183-187.DOI:10.7506/spkx1002-6630-201405036.
[2]MEISEL H,BOCKELAANN W. Bioactive peptides encrypted in milk proteins: proteolytic activation and thropho-functional properties[J]. Antonie Van Leeuwenhoek, 1999, 76(1/4): 207-215. DOI:10.1023/ A:1002063805780.
[3]ABEYRATHNE E D N S, LEE H Y, JO C, et al. Enzymatic hydrolysis of ovomucin and the functional and structural characteristics of peptides in the hydrolysates[J]. Food Chemistry, 2016, 192: 107-113. DOI:10.1016/j.foodchem.2015.06.055.
[4]孙协军, 李秀霞, 蔡路昀, 等. 鲅鱼蛋白水解产物功能性质分析[J]. 食品工业科技, 2015, 36(6): 179-184. DOI:10.13386/ j.issn1002-0306.2015.06.032.
[5]JIA J, ZHOU Y, LU J, et al. Enzymatic hydrolysis of Alaska pollack (Theragra chalcogramma) skin and antioxidant activity of the resulting hydrolysate[J]. Journal of the Science of Food and Agriculture, 2010,90(4): 635-640. DOI:10.1002/jsfa.3861.
[6]胡方园. 酶法制备鳙鱼低聚肽及其抗氧化活性研究[D]. 无锡: 江南大学, 2012.
[7]MEGIAS C, PEDROCHE J, YUST M D M, et al. Sunflower protein hydrolysates reduce cholesterol micellar solubility[J]. Plant Foods for Human Nutrition, 2009, 64(2): 86-93. DOI: 10.1007/s11130-009-0108-1.
[8]ROBITAILLE G, LAPOINTE C, LECLERC D, et al. Effect of pepsintreated bovine and goat casein omacropeptide on Escherichia coli and Lactobacillus rhamnosus in acidic conditions[J]. Journal of Dairy Science, 2012, 95(1): 1-8. DOI:10.3168/jds.2010-4142.
[9]HOYLE N T, MERRLTT J H. Quality of fish protein hydrolysates from herring (Clupea harengus)[J]. Journal of Food Science, 1994,59(1): 76-79. DOI:10.1111/j.1365-2621.1994.tb06901.x.
[10]JAMDAR S N, RAJALAKSHMI V, PEDNEKAR M D, et al. Influence of degree of hydrolysis on functional properties, antioxidant activity and ACE inhibitory activity of peanut hydrolysate[J]. Food Chemistry, 2010, 121(1): 178-184. DOI: 10.1016/ j.foodchem.2009.12.027.
[11]BYUN H G, LEE J K, PARK H G, et al. Antioxidant peptides isolated from the marine rotifer, Brachionus rotundiformis[J]. Process Biochemistry, 2009, 44(8): 842-846. DOI:10.1016/ j.procbio.2009.04.003.
[12]赵玉红, 王玮. 鱼蛋白水解物功能特性的研究[J]. 东北农业大学学报, 2001, 32(2): 175-180.
[13]WASSWA J, TANG J, GU X H, et al. Influence of the extent of enzymatic hydrolysis on the functional properties of protein hydrolysate from grass carp (Ctenopharyngodon idella) skin[J]. Food Chemistry, 2007, 104(4): 1698-1704. DOI:10.1016/ j.foodchem.2007.03.044.
[14]刁静静, 孔保华, 陈洪生. 骨蛋白水解物的功能特性及抗氧化性的研究进展[J]. 肉类研究, 2007, 21(6): 26-29. DOI:10.3969/ j.issn.1001-8123.2007.06.012.
[15] 郭浩楠, 袁晓晴, 杨荣华. 鲢鱼蛋白的酶解及其酶解物功能性的研究[C]//中国食品科学技术学会第六届年会暨第五届东西方食品业高层论坛论文摘要集, 2009.
[16]袁晓晴, 胡燕. 鳙鱼鱼肉蛋白的酶解及其对功能性质的影响[J]. 食品科技, 2012(7): 136-139.
[17]李雪, 罗永康, 尤娟. 草鱼鱼肉蛋白酶解物抗氧化性及功能特性研究[J]. 中国农业大学学报, 2011(1): 94-99.
[18]FUJIWARA K, OOSAWA T, SAEKI H. Improved thermal stability and emulsifying properties of carp myofibrillar proteins by conjugation with dextran[J]. Journal of Agricultural and Food Chemistry, 1998,46(4): 1257-1261. DOI:10.1021/jf9708148.
[19]PEARCE K N, KINSELLA J E. Emulsifying properties of proteins:evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723. DOI:10.1021/jf60217a041.
[20]BOUGATE A, NEDJAR-ARROUME N, MANNI L, et al. Purification and identification of novel antioxidant peptides from enzymatic hydrolysates of (Sardinella aurita) by-products proteins[J]. Food Chemistry, 2010, 118(3): 559-565. DOI:10.1016/ j.foodchem.2009.05.021.
[21]DECKER E A, WELCH B. Role of ferritin as a lipid oxidation catalyst in muscle food[J]. Journal of Agricultural and Food Chemistry, 1990,38(3): 674-677. DOI:10.1021/jf00093a019.
[22]YILDIRIM A, MAVI A, KARA A A. Determination of antioxidant and antimicrobial activities of Rumex crispus L. extracts[J]. Journal of Agricultural and Food Chemistry, 2001, 49(8): 4083-4089. DOI:10.1021/jf0103572.
[23]李雪, 罗永康, 吕元萌, 等. 鲽鱼下脚料酶解产物的功能特性[J]. 肉类研究, 2011, 25(7): 5-7.
[24]史策, 韩烽烽, 刘鹏, 等. 鳕鱼和鲅鱼鱼肉蛋白酶解产物功能特性及抗氧化性[J]. 肉类研究, 2013, 27(8): 5-7.
[25]陈志军, 李向红, 刘永乐, 等. 鲢鱼蛋白酶法水解产物的功能性质[J].食品科学, 2012, 33(5): 62-65.
[26]CHOBERT J M, BERTRAND-HARB C, NICOLAS M G. Solubility and emulsifying properties of caseins and whey proteins modified enzymically by trypsin[J]. Journal of Agricultural and Food Chemistry,1988, 5: 883-892. DOI:10.1021/jf00083a002.
[27]LIU Q, KONG B H, XIONG Y L, et al. Antioxidant activity and functional properties of porcine plasma protein hydrolysate as influenced by the degree of hydrolysis[J]. Food Chemistry, 2010,118(2): 403-410. DOI:10.1016/j.foodchem.2009.05.013.
[28]CARRASCO-CASTILLA J, HERNANDEZ-ALVAREZ A J,JIMENEZ-MARTINEZ C, et al. Antioxidant and metal chelating activities of peptide fractions from phaseolin and bean protein hydrolysates[J]. Food Chemistry, 2012, 135(3): 1789-1795. DOI:10.1016/j.foodchem.2012.06.016.
[29]XUE L, LUO Y, SHEN H, et al. Antioxidant activities and functional properties of grass carp (Ctenopharyngodon idellus) protein hydrolysates[J]. Journal of the Science of Food and Agriculture, 2012,92(2): 292-298. DOI:10.1002/jsfa.4574.
[30]安然, 罗永康, 尤娟, 等. 草鱼鱼鳞蛋白酶解产物功能特性及其抗氧化活性[J]. 食品与发酵工业, 2011, 37(8): 76-80. DOI:10.13995/ j.cnki.11-1802/ts.2011.08.030.
[31]POWNALL T L, UDENIGWE C C, ALUKO R E. Amino acid composition and antioxidant properties of pea seed (Pisum sativum L.)enzymatic protein hydrolysate fractions[J]. Journal of Agricultural and Food Chemistry, 2010, 58(8): 4712-4718. DOI:10.1021/jf904456r.
Processing Properties and Antioxidant Activity of Protein Hydrolysates from Bighead Carp (Aristichthys nobilis)Meat Produced with Two Different Proteases
LI Dongping
1, ZHANG Zhan
1, GUO Shanshan
2, LUO Yongkang
1,*
(1.College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China;2.Shandong Hanlong Biological Science and Technology Co. Ltd., Binzhou 256600, China)
Abstract:The goal of the present work was to investigate the antioxidant activity and processing properties of protein hydrolysates prepared by enzymatic hydrolysis of bighead carp (Aristichthys nobilis) meat with two different enzymes,namely Alcalase and Flavourzyme, as a function of hydrolysis time, pH value and the molecular weights of protein hydrolysates. The results showed that the solubility and thermal stability of the two protease hydrolysis products at pH 4 were lower than those at pH 7. Protein hydrolysates obtained after 4.0 and 1.0 h of hydrolysis with both enzymes had a better solubility and thermal stability, respectively. At the same hydrolysis time, protein hydrolysates from Alcalase had a better metal chelating activity than those from Flavourzyme. However, the emulsifying activity index (EAI), DPPH radical scavenging capacity and reducing power of Flavourzyme protein hydrolysates were better than those of Alcalase protein hydrolysates. This finding revealed that the antioxidant activity and processing properties of protein hydrolysates from bighead carp meat were determined by hydrolysis time, pH value, the kind of enzyme used, and the molecular weight of protein hydrolysates.
Key words:bighead carp (Aristichthys nobilis); meat; protein hydrolysates; processing properties; antioxidant activity
DOI:10.15922/j.cnki.rlyj.2016.06.001
中图分类号:TS254.1
文献标志码:A
文章编号:1001-8123(2016)06-0001-05
收稿日期:2016-01-17
基金项目:国家现代农业(鱼类)产业技术体系建设专项(CARS-46);“十二五”国家科技支撑计划项目(2015BAD17B03)
作者简介:李东萍(1993—),女,硕士,研究方向为农产品加工及贮藏工程。E-mail:lidongping9797@163.com
*
通信作者:罗永康(1964—),男,教授,博士,研究方向为水产品贮藏与加工。E-mail:luoyongkang@263.net