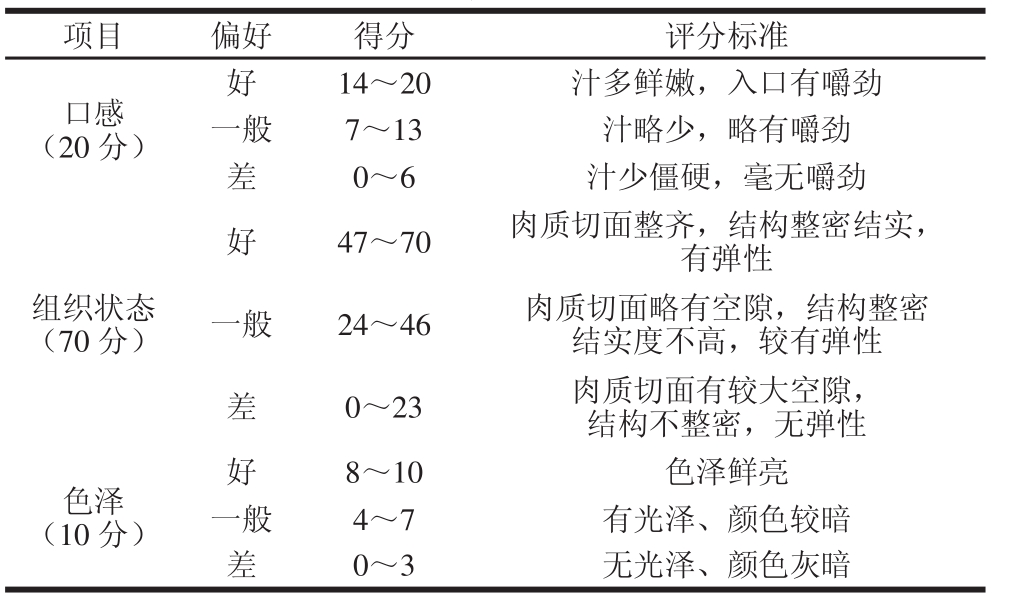
表1 肉蛋白凝胶感官评价标准
Table 1 Criteria for sensory evaluation of meat protein gel
张根生,张毅超,程健博,李婷婷,姜 艳,姚 烨
(哈尔滨商业大学 黑龙江省普通高等学校食品科学与工程重点实验室,黑龙江 哈尔滨 150076)
摘 要:以生鲜猪肉为主要原料,经过谷氨酰胺转胺酶(transglutaminase,TG)反应后加热形成凝胶,通过单因素和正交试验,并以质构特性和感官评价为指标,利用低频核磁共振技术对最优方案进行比较验证,从而确定肉蛋白凝胶最优制备工艺。结果表明:肉蛋白凝胶最佳配方为:TG添加量1.2 U/g、食盐添加量2.5%、大豆蛋白添加量1.0%、酪蛋白添加量0.6%、水添加量25%,在此条件下制成的蛋白凝胶硬度达到3 986.156 g、弹性达到0.989、凝聚性达到0.873、回复性达到0.579、感官评分达到89.03 分,形成的肉蛋白凝胶体切面整齐,且富有弹性。
关键词:肉蛋白凝胶;谷氨酰胺转胺酶;低频核磁共振
张根生, 张毅超, 程建博, 等. 肉蛋白凝胶工艺优化及其低频核磁共振法的验证[J]. 肉类研究, 2016, 30(2): 15-20.
ZHANG Gensheng, ZHANG Yichao, CHENG Jianbo, et al. Optimization of meat protein gelation and validation by low-frequency nuclear magnetic resonance[J]. Meat Research, 2016, 30(2): 15-20. (in Chinese with English abstract)
蛋白凝胶是指蛋白质分子的聚集现象,在这种聚集过程中,吸引力和排斥力处于平衡,以至于形成能保持大量水分子的高度有序稳定的三维网络结构或者基体[1]。近年来发现利用谷氨酰胺转胺酶(transglutaminase,TG)可以很好地处理肉蛋白凝胶,王顺风[2]、孙高军[3]、翁航萍[4]、胡斌[5]等对此都有过很好的研究,国外如Schaake[6]、Berry[7]等对凝胶的研究大都集中在改善产品的组织结构和外观。过去一些学者对凝胶保水性的测定停留在基本的方法,如Grau等[8]用滤纸吸水法,Honikel[9]用离心法。而低频核磁共振(low-frequency nuclear magnetic resonance,L-NMR)技术作为一种新型快速无损检测得到了人们的认可[10-11],通过测定弛豫时间T2,利用弛豫时间的不同进行分析区别物理化学作用下结合的水[12],间接反应水分自由度[13]。
本研究利用TG在较低温下的反应,将肉糜中的肉蛋白与非肉蛋白重新组合加热后形成凝胶,通过单因素及正交试验确定最优工艺,再利用L-NMR技术对最优工艺进行比较验证,为实验结果提供可靠的依据。
1.1 材料与试剂
一级猪肉 市售;TG(500 U/g) 日本味之素株式会社;大豆蛋白 吉林不二蛋白有限公司;酪蛋白兰州同健生物科技有限公司;食用盐(食品级) 市售。
1.2 仪器与设备
GB204电子天平 上海天普分析仪器有限公司;HHS-12型电热恒温水浴锅 上海东星建材试验设备有限公司;TA-XT2i质构仪 英国SMS公司;NM 120型核磁共振分析仪 上海纽迈电子科技有限公司。
1.3 方法
1.3.1 热凝胶混合体系的工艺流程
原料肉→预处理→绞碎→混拌→成型→反应→熟制→冷却→测定
1.3.2 蛋白质热凝胶混合体系的操作要点
1)预处理:去除生鲜猪肉中的脂肪、筋腱等组织;2)绞碎:将预处理好的猪肉通过绞肉机搅碎,制成肉糜;3)混拌:称取肉糜,50 g为一组,放入烧杯中,然后将事先称量好的TG、食盐、大豆蛋白、酪蛋白加入,搅拌均匀;4)成型:将搅拌均匀的材料放入模具中成型;5)反应:将成型后的产品放入温度为25 ℃的恒温水浴锅中反应4 h;6)煮制:将反应完成的肉糜从恒温水浴锅中取出,放入80~90 ℃水浴中煮制20~30 min,直至中心温度达到85 ℃;7)冷却:然后将熟制好的样品取出,冷却至室温。
1.3.3 质构特性(texture profi le analysis,TPA)的测定[14]
制成的热凝胶冷却后切成1 cm×1 cm×1 cm方块,用质构仪测定其硬度、弹性、凝聚性和回复性。TPA测定前探头速率:2.0 mm/s,测试探头速率:1.0 mm/s,测定后探头速率:1.0 mm/s,测定距离:10.00 mm,压缩比:30%,探头两次测定时间间隔:5.00 s,每个样品重复3 次取平均值。
1.3.4 感官评价
结合本产品特点,评分标准如表1所示。由12 名经培训的人员对样品进行感官评定并评分满分为100 分。
表1 肉蛋白凝胶感官评价标准
Table 1 Criteria for sensory evaluation of meat protein gel

1.3.5 LF-NMR的测定[15-16]
硬脉冲F I D参数为P1= 1 4,T W = 4 0 0 0,TD=8 000 032,SW=200,DRG=3,SF=18,O1=430 811.1,RG=20,NS=4。SF(MHz)和O1(KHz)共同表示中心频率,其中O1(KHz)每次检测均需重新调节。P1(μs)90度脉冲宽度对于同一类样品基本不变,然后进入硬脉冲CPMG序列测定。硬脉冲CPMG序列各项参数为:P1=14,P2=28,TW=4 000,DRG=3,SW=200,DFW=30.0,SF1=18,O1=430 811.1,RG1=20,NS=4。SF(MHz)和O1(KHz)即为硬脉冲FID序列中所调的中心频率,将准备好的样品放入磁场开始采样,采样结束后进行T2拟合,保存实验结果,然后进入T2反演,经核磁分析软件反演出实验结果。每个样品重复3 次取平均值。
1.3.6 肉蛋白凝胶单因素试验
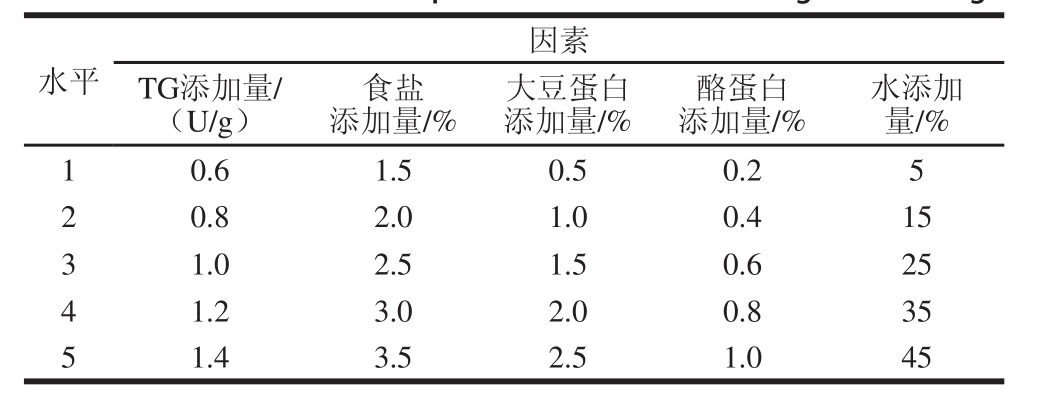
取绞碎后的肉糜放入烧杯,基础参考配方为TG添加量1.0 U/g、盐添加量2.5%、大豆蛋白添加量1.0%、酪蛋白添加量0.5%、水添加量25%,在25 ℃条件下反应4 h,将熟制好的凝胶取出冷却,以硬度、弹性、凝聚性、回复性和感官评价为评价指标[17],分别探讨TG、盐、大豆蛋白、酪蛋白和水的添加量对蛋白热凝胶的硬度、弹性、凝聚性、回复性和感官评价的影响。各因素水平取值见表2。
表2 单因素试验设计
Table 2 Coded levels for independent variables used in single factor design
1.3.7 肉蛋白凝胶正交试验
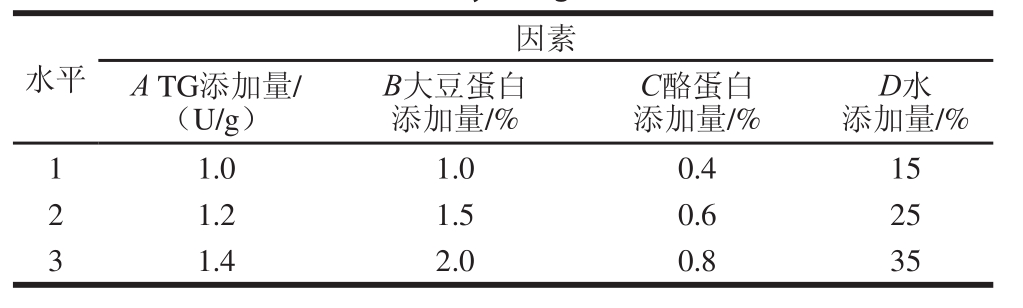
在单因素试验的基础上,选取TG、大豆蛋白、酪蛋白、水添加量这4 个影响较大的因素,以硬度、弹性、凝聚性、回复性和感官评价为指标,对其进行L9(34)正交试验,并用低频核磁共振技术对最佳方案进行验证,确定最佳工艺配方。因素表取值见表2。
表2 正交试验设计
Table 2 Coded levels for independent variables used in orthogonal array design
2.1 肉蛋白凝胶单因素试验
2.1.1 TG添加量对肉蛋白凝胶TPA和感官评价的影响
表3 TG添加量对肉蛋白凝胶TPA和感官评价的影响
Table 3 Effect of TG enzyme dosage on TPA and sensory evaluation of porcine protein gels

注:同列字母不同,表示差异显著(P<0.05)。下同。
由表3可知,随着TG添加量的增加,在0.6~1.4 U/g的范围内,肉蛋白凝胶硬度、弹性、凝聚性、回复性和感官评分都出现了先上升后下降的趋势,除了回复性在1.0 U/g取得最大值,其他皆在1.2 U/g时取得最大值。TG能催化蛋白分子之内和分子之间形成稳定的三维结构,使产品的交联度增大,致密性提高,凝胶孔径变小。因此选择TG的最适添加量为1.2 U/g。
2.1.2 食盐添加量对肉蛋白凝胶TPA和感官评价的影响
表4 食盐添加量对肉蛋白凝胶TPA和感官评价的影响
Table 4 Effect of salt concentration on TPA and sensory evaluation of porcine protein gels
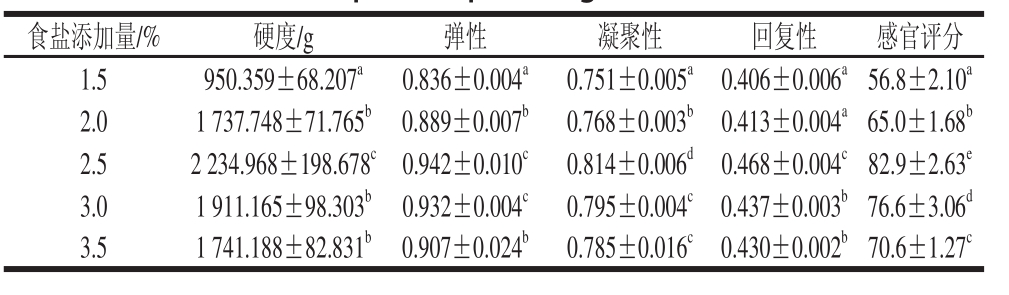
由表4可知,刚开始随着食盐的添加量增加,肉蛋白凝胶硬度、弹性和感官评分迅速增加,凝聚性和回复性也随之逐渐增加,当食盐的添加量超过2.5%时继续添加,硬度、弹性等和感官评分都逐渐降低。食盐的添加使得蛋白质的状态从非溶解态变成溶解态,提高了肉蛋白的含量,但溶解达到饱和后继续加食盐会反过来影响酶反应。因此选择食盐的最适添加量为2.5%。
2.1.3 大豆蛋白添加量对肉蛋白凝胶TPA和感官评价的影响
表5 大豆蛋白添加量对肉蛋白凝胶TPA和感官评价的影响
Table 5 Effect of soy protein isolate concentration on TPA and sensory evaluation of porcine protein gels
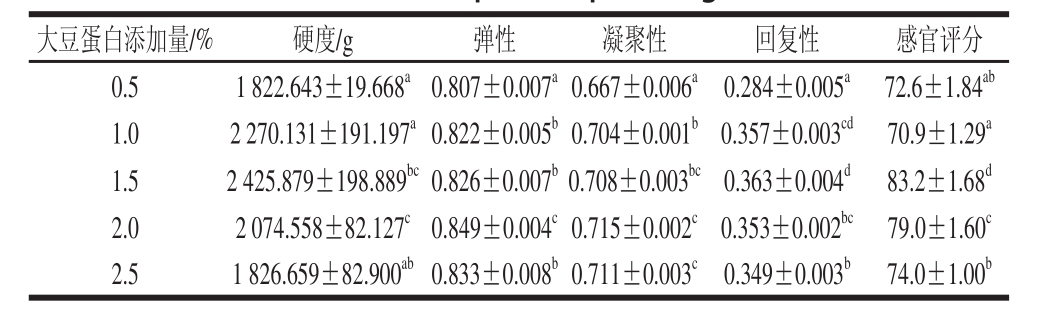
由表5可知,在0.5%~2.5%的范围内,肉蛋白凝胶硬度、弹性、回复性和凝聚性都出现了先上升后下降的趋势,硬度、回复性在1.5%取得最大值,弹性、凝聚性在2.0%取得最大值,感官评分开始略微下降后迅速上升,并在1.5%取得最大值,而后逐渐下降。大豆蛋白分子遇水后能令其网状结构松弛下来,使更多的水分子被包围在这个网状结构里,改善表面形态和组织特性,提高产品的质地。因此大豆蛋白的最适添加量为1.5%。
2.1.4 酪蛋白添加量对肉蛋白凝胶TPA和感官评价的影响
表6 酪蛋白添加量对肉蛋白凝胶TPA和感官评价的影响
Table 6 Effect of casein concentration on TPA and sensory evaluation of porcine protein gels
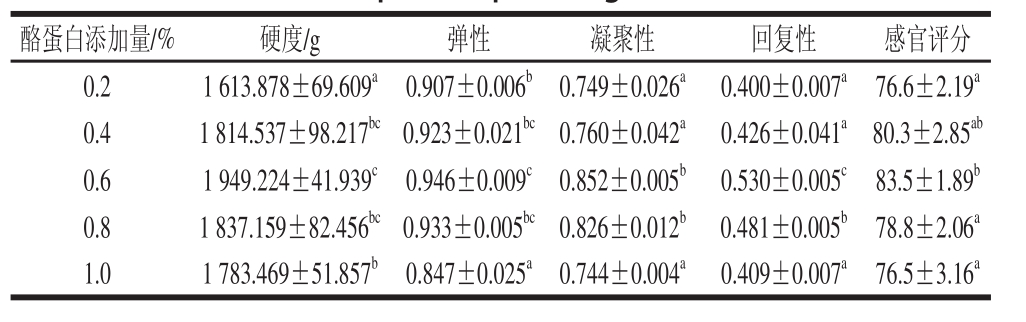
由表6可知,在0.2%~1.0%的范围内,肉蛋白凝胶硬度、弹性、回复性、凝聚性和感官评分都出现了先上升后下降的趋势,并在0.6%取得最大值。酪蛋白对水分的截留作用,它通过TG与肉蛋白发生交联反应,能达到很大的黏合度,增强稳定性。因此酪蛋白的最适添加量为0.6%。
2.1.5 水添加量对肉蛋白凝胶TPA和感官评价的影响
表7 水添加量对肉蛋白凝胶TPA和感官评价的影响
Table 7 Effect of water content on TPA and sensory evaluation of porcine protein gels

由表7可知,在5%~45%的范围内,肉蛋白凝胶硬度、回复性和感官评分都出现了先上升后下降的趋势,并在25%取得最大值,弹性随着添加量的增加也一直增加,而凝聚性刚开始增加后就基本保持不变。添加水能有效改变蛋白凝胶含水量,但若加水量超过它的持水能力,被盐溶解出的肉蛋白会被稀释冲淡,黏合强度会大幅下降,因此水的最适添加量为25%。
2.2 肉蛋白凝胶正交试验结果
表8 肉蛋白凝胶的正交试验结果
Table 8 Orthogonal array design with experimental results for the optimization of meat protein gel formulations
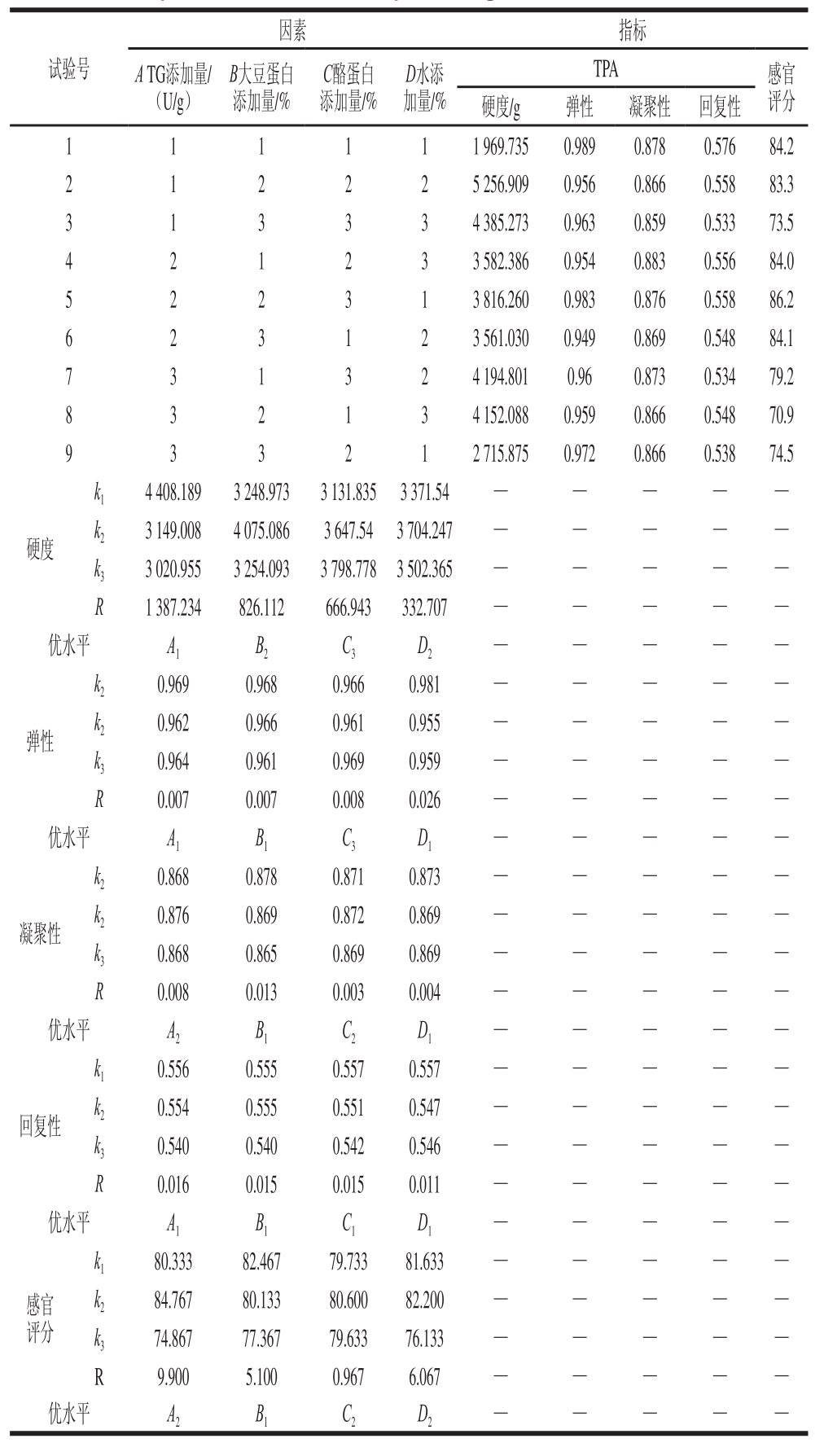
由表8可知,各因素对肉蛋白凝胶的硬度影响大小次序为:A>B>C>D,最优方案为A1B2C3D2,这个组合并不在9 次试验中,所以对其进行验证,结果显示,此方案下感官评分为86.8 分;各因素对肉蛋白凝胶的弹性影响大小次序为:D>B>C=A,最优方案为A1B1C3D1,这个组合并不在9次试验中,所以对其进行验证,结果显示,此方案下感官评分为85.9 分;各因素对肉蛋白凝胶的凝聚性影响大小次序为:B>A>D>C,最优方案为A2B1C2D1,这个组合并不在9次试验中,所以对其进行验证,结果显示,此方案下感官评分为83.4 分;各因素对肉蛋白凝胶的回复性影响大小次序为:A>B=C>D,最优方案为A1B1C1D1,此方案下感官评分为84.2 分;各因素对肉蛋白凝胶的感官评价影响大小次序为:A>D>B>C,最优方案为A2B1C2D2,这个组合并不在9 次试验中,所以对其进行验证,结果显示,此方案下感官评分为89.0 分。综合考虑极差分析结果,以感官评价为主导,即TG添加量>水添加量>大豆蛋白添加量>酪蛋白添加量,选择最优方案为A2B1C2D2,即TG添加量1.2 U/g、大豆蛋白添加量1.0%、酪蛋白添加量0.6%、水添加量25%,此方案下硬度为3 986.156 g、弹性为0.989、凝聚性为0.873、回复性为0.579、感官评分为89.0 分。
2.3 L-NMR法比较验证
用低频核磁共振技术对这5 个方案进行检测,横向驰豫时间(T2)分别对应有结合水、不易流动水和自由水3 种形态水。其中T21(0~10 ms)表示蛋白质分子表面的极性基团与水分子紧密结合的水分子层,也称为结合水。T22(10~100 ms)表示存在于肌纤丝、肌原纤维及膜之间的不易流动水,占总水分的80%左右,T23(100~1 000 ms)表示存在于细胞外的间隙中能自由流动的水[18],横向弛豫时间可以表明水分的自由度[19]。弛豫时间越小水分越不易流动,弛豫时间越大流动性越高,峰面积越小水分含量越少,峰面积越大水分含量越大。
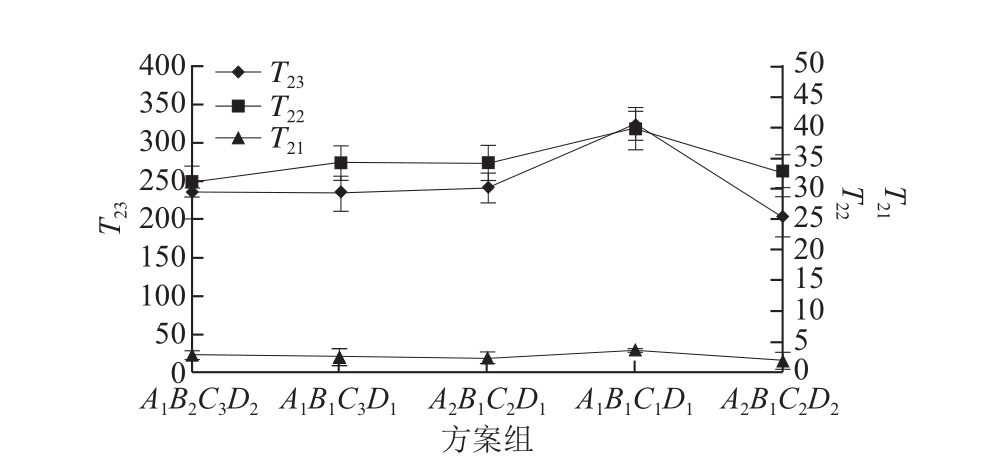
图1 各方案组对弛豫时间T2的影响
Fig.1 Relaxation time T2of selected meat protein gel formulations
由图1可知,弛豫时间T21由高到低的顺序为A1B1C1D1>A1B2C3D2>A1B1C3D1>A2B1C2D1>A2B1C2D2,结合水的流动性依次逐渐降低,说明方案A2B1C2D2的结合水最为稳定,这是由于TG能使谷氨酰胺残基与水分子结合发生脱氨基反应,增加TG的量可以使得更多的水分子与蛋白分子结合,提高结合水的稳定性。弛豫时间T22由高到低的顺序为A1B1C1D1>A2B1C2D1>A1B1C3D1>A1B2C3D2>A2B1C2D2,不易流动水的流动性依次逐渐降低,说明方案A2B1C2D2的不易流动水最偏向于结合水,这是由于充足的酶反应形成高度有序的三维空间网状结构锁住了大量的水分子,同时较密的凝胶结构增大了蛋白与孔径的水的接触面积,它们之间的相互作用降低了流动性[20],弛豫时间T23由高到低的顺序为A1B1C1D1>A2B1C2D1>A1B2C3D2>A1B1C3D1>A2B1C2D2,自由水的流动性依次逐渐降低,说明方案A2B1C2D2的自由水流动性最低,这是因为交联反应形成的凝胶孔径较小,水分在凝胶网络中没有足够自由移动的空间[21]。
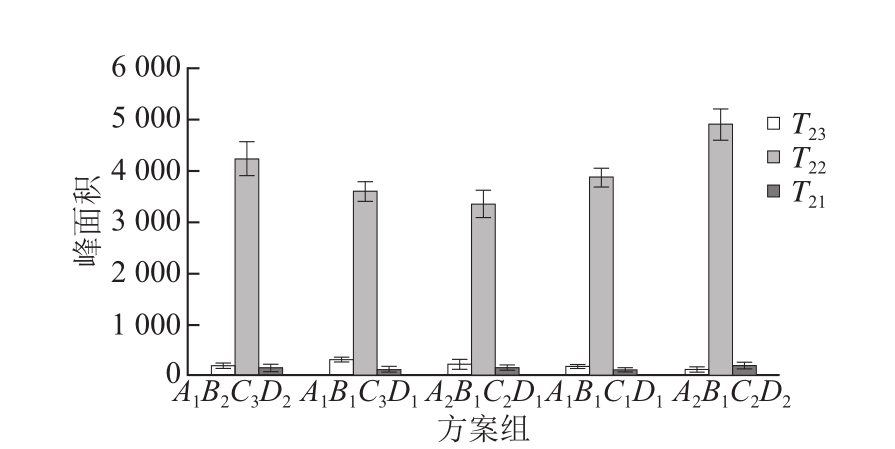
图2 各方案组对T2峰面积的影响
Fig.2 T2peak areas of selected meat protein gel formulations
由图2可知,T2 1的峰面积由高到低的顺序为A2B1C2D2>A2B1C2D1>A1B2C3D2>A1B1C3D1>A1B1C1D1,其中方案A2B1C2D2的峰面积最大,其结合水的含量最高,这是由于TG能使谷氨酰胺残基与水分子结合发生脱氨基反应,增加TG的量可以使得更多的水分子与蛋白分子结合,有效地增加了结合水的量。T22的峰面积由高到低的顺序为A2B1C2D2>A1B2C3D2>A1B1C1D1>A1B1C3D1>A2B1C2D1,其中方案A2B1C2D2的峰面积最大,其不易流动水的含量最高,这是因为增加水的添加量能有效地提高水分含量,且交联形成的凝胶三维网状结构使得大量的水分子充斥其中,另一方面大豆蛋白分子遇水后能令其网状结构松弛下来,使更多的水分子被包围在这个网状结构里,但这也会导致它抢夺一定量的水分子,酪蛋白在一定程度上对水分子具有截留作用[22]。T23的峰面积由高到低的顺序为A1B1C3D1>A2B1C2D1>A1B1C1D1>A1B2C3D2>A2B1C2D2,其中方案A2B1C2D2的峰面积最小,其自由水的含量最低,这是由于交联反应形成的凝胶致密性好,孔径较小,水分在凝胶网络中没有足够多余的空间[23]。
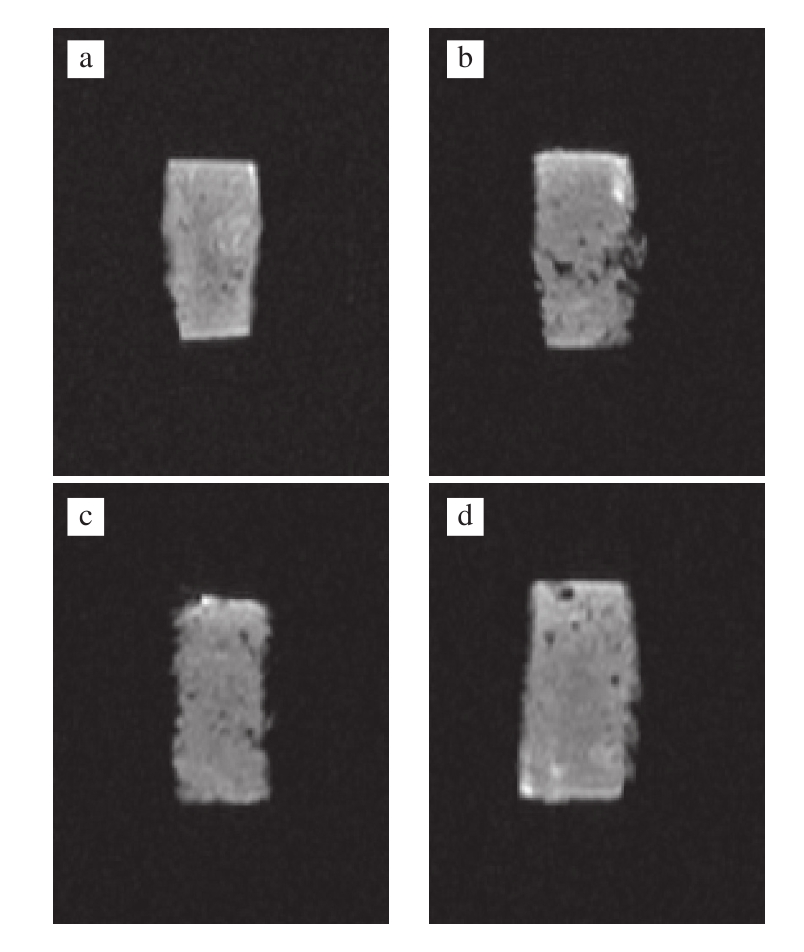
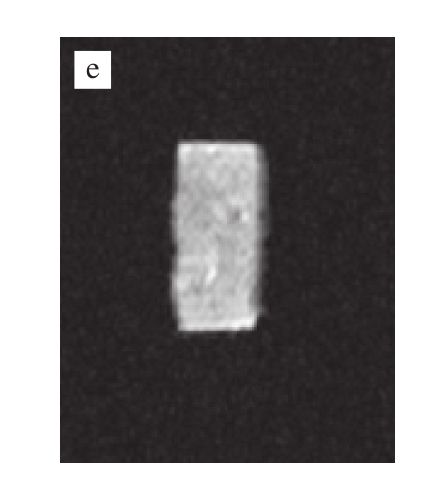
a~e.依次为A1B2C3D2、A1B1C3D1、A2B1C2D1、A1B1C1D1、A2B1C2D2方案。
图 3 各方案组的低频核磁成像
Fig.3 L-NMR images of selected meat protein gel formulations
由图3可知,方案A2B1C2D2的成像最清楚,完整性也最好,结合以上弛豫时间和峰面积的分析可以判断出方案A2B1C2D2的保水性和持水能力是这5 个方案里最优秀的,因此选择最佳方案为A2B1C2D2,即TG添加量1.2 U/g、大豆蛋白添加量1.0%、酪蛋白添加量0.6%、水添加量25%。
3
通过单因素及正交试验得出肉蛋白热凝胶最佳配方为TG添加量1.2 U/g、食盐添加量2.5%、大豆蛋白添加量1.0%、酪蛋白添加量0.6%、水添加量25%,并通过L-NMR技术验证了该配方为最佳配方。在此条件下制成的蛋白凝胶硬度达到3 986.156 g、弹性达到0.989、凝聚性达到0.873、回复性达到0.579、感官评分达到89.03 分,形成的凝胶凝固有形,且富有弹性。
参考文献:
[1] HERMASSAN A M. Aggregation and denaturation involed in gel formation[M]//POURL A. Functionality and protein strure. Washington DC. American Chemical Society, 1979: 82-103.
[2] 王顺风, 戚士初, 潘超, 等. 谷氨酰胺转氨酶及其在肉产品加工中的应用[J]. 肉类研究, 2008, 22(7): 42-45.
[3] 孙高军, 马飞, 聂兴龙, 等. 结冷胶和谷氨酰胺转氨酶对牛肉凝胶持水性与硬度的影响[J]. 肉类研究, 2011, 25(8): 6-11.
[4] 翁航萍. 谷氨酰胺转氨酶特性及其在肉制品中的应用[J]. 肉类研究, 2010, 24(1): 15-17.
[5] 胡斌, 张孝刚, 周杨. 重组发酵火腿中生物胺含量的变化[J]. 肉类研究, 2012, 26(4): 16-20.
[6] SCHAAKE S L, MEANS W J, MOODY W G, et al. Boning methods and binders affect bind and sensory characteristics of structured beef[J]. Journal of Food Science, 1993, 58(6): 1231-1237. DOI:10.1016/S0309-1740(03)00061-5.
[7] BERRY B W, BIGNER-GEORGE M E, EASTRIDGE J S. Hot processing and grind size affect properties ofcooked beef patties[J]. Meat Science, 1999, 53(1): 37-43. DOI:10.1016/S0309-1740(99)00034-0.
[8] GRAUR, HAMM R, BAUMANN A. Water-binding capacity of dead mammal muscle. I. Effect of pH value on water-binding capacity of crushed cattle muscle[J]. Biochemische Zeitschrift, 1953, 325(1): 1-11.
[9] HONIKEL K O. Reference methods for the assessment of physical characteristics of meat[J]. Meat Science, 1998, 49(4): 447-457. DOI:10.1016/S0309-1740(98)00034-5.
[10] BERTRAM H C, ANDERSEN H J. NMR and the water-holding issue of pork[J]. Journal of Animal Breeding and Genetics, 2007, 124(Suppl 1): 35-42. DOI:10.1111/j.1439-0388.2007.00685.x.
[11] BERTRAM H C, KOHLER A, BOCKER U, et al. Heat-induced changes in myofibrillar protein structures and myowater of two pork qualities. A combined FT-IR spectroscopy and low-field NMR relaxometry study[J]. Journal of Agricultural and Food Chemistry, 2006, 54(5): 1740-1746. DOI:10.1021/jf0514726.
[12] TROUT G R. Techniques for measuring water-binding capacity in muscle foods: a review of methodology[J]. Meat Science, 1988, 23(4): 235-252. DOI:10.1016/0309-1740(88)90009-5.
[13] HINRICHS R, GOTZ J, NOLL M, et al. Characterisation of the water-holding capacity of fresh cheese samples by means of low resolutionnuclear magnetic resonance[J]. Food Research International, 2004, 37(7): 667-676. DOI:10.1016/j.foodres.2004.02.005.
[14] 冯锦聪, 李诚, 姚尧, 等. 谷氨酰胺转氨酶对鹅肉肉糜凝胶特性的影响[J]. 食品工业, 2013, 34(11): 66-70.
[15] 吴烨, 许柯, 徐幸莲, 等. 低场核磁共振研究pH值对兔肌球蛋白热凝胶特性的影响[J]. 食品科学, 2010, 31(9): 6-11.
[16] 李伟妮, 韩剑众. 冷藏山羊肉品质变化的核磁共振研究[J]. 食品工业科技, 2010, 31(1): 125-127
[17] 张卫佳. 转谷氨酰胺酶以及非肉蛋白在肉类加工中的应用研究[D].成都: 西华大学, 2006. DOI:10.7666/d.y1252655.
[18] HANNE C B, ANDERSEN H J, KARLSSON A H. Comparative study of low-field NMR relaxa tion measurements and two traditional methods in the determination of water holding capacity of pork[J]. Meat Science, 2001, 57: 125-132. DOI:10.1016/S0309-1740(00)00080-2.
[19] CHALAND B, MARIETTE F, MARCHAL P, et al.1H-Nuclear magnetic resonance relaxometric characterization of fat and water states in soft and hard cheese[J]. Journal of Dairy Research, 2000, 67(4): 609-618.
[20] BERTRAM H C, WHITTAKER A K, ANDERSEN H J, et al. pH dependence of the progression in NMR T2relaxation times in postmortem muscle[J]. Journal of Agricultural and Food Chemistry, 2003, 51(14): 4072-4078. DOI:10.1021/bi0481141.
[21] BERTRAM H C, ENGELSEN S B, BUSK H, et al. Water properties during cooking of pork studied by low-field NMR relaxation: effects of curing and the RN-gene[J]. Meat Science, 2004, 66(2): 437-446. DOI:10.1016/S0309-1740(03)00132-3.
[22] GOETZ J, KOEHLER P. Study of the thermal denaturation of selected proteins of whey and egg by low resolution NMR[J]. LWTFood Science and Technology, 2005, 38(5): 501-512. DOI:10.1016/ j.bmcl.2007.07.030.
[23] HAN Minyi, ZHANG Yingjun, FEI Ying, et al. Effect of microbial transglutaminase on NMR relaxometry and microstructure of pork myofibrillar protein gel[J]. European Food Research and Technology, 2009, 228(4): 665-670. DOI:10.1007/s00217-008-0976-x.
ZHANG Gensheng, ZHANG Yichao, CHENG Jianbo, LI Tingting, JIANG Yan, YAO Ye
(Key Laboratory for Food Science and Engineering of Heilongjiang Province, Harbin University of Commerce, Harbin 150076, China)
Abstract: The optimization of heat-induced gel formulations prepared from transglutaminse (TG)-treated porcine muscle proteins based on texture properties and sensory evaluation was carried out using single factor and orthogonal array experiments and validated by low-frequency nuclear magnetic resonance (L-NMR). The results showed the optimal formulation was determined as follows: TG 1.2 U/g, salt 2.5%, soy protein 1.0%, casein 0.6%, and water 25%. The formed gel had a hardness of 3 986.156 g, elasticity of 0.989, cohesiveness of 0.873, resilience of 0.579, and sensory score of 89.03. It could be cut into regular sections, having excellent elasticity.
Key words: meat protein gel; transglutaminse (TG); low-frequency nuclear magnetic resonance (L-NMR)
作者简介:张根生(1964—),男,教授,硕士,研究方向为畜产品加工。E-mail:zhanggsh@163.com
基金项目:哈尔滨商业大学研究生创新项目(YJSCX2015-393HSD)
收稿日期:2015-10-29
中图分类号:TS251.1
文献标志码:A
文章编号:1001-8123(2016)02-0015-06
DOI:10.15922/j.cnki.rlyj.2016.02.004 10.15922/j.cnki.rlyj.2016.02.004. http://rlyj.cbpt.cnki.net 10.15922/j.cnki.rlyj.2016.02.004. http://rlyj.cbpt.cnki.net
引文格式: