肉制品中牛源性成分荧光定量聚合酶链式反应方法的建立与应用
苗 丽
1,李志娟
2,王 珊
2,张秀平
2,陈 静
2
(1.河南出入境检验检疫局检验检疫技术中心,河南 郑州 450003;
2.河南检验检疫鉴定咨询中心,河南 郑州 450003)
摘 要:为了能够快速准确检测出市场中掺假牛肉制品,采用TaqMan探针法,建立一种用于快速有效检测牛肉制品中牛源性成分的荧光定量聚合酶链式反应(polymerase chain reaction,PCR)方法。选择GenBank中牛β-actin基因的保守序列,设计并合成特异性引物及TaqMan探针,以构建的pMD-18T-96-beef质粒为标准品,优化反应条件。结果表明:重组质粒标准品经PCR、测序和酶切鉴定正确,建立的标准曲线Ct值与模板拷贝数对数值之间呈良好的线性关系,相关系数为0.98,斜率为-3.345,敏感度为46.1 copies/μL。特异性实验表明,用该方法检测猪肉、羊肉、鸡肉、鸭肉、鹅肉等非牛肉制品结果均为阴性。批内重复实验变异系数均小于0.98%,批间重复实验变异系数均小于0.33%,表明该方法重复性良好。用建立的荧光定量PCR方法与SN/T 2051—2008《食品、化妆品和饲料中牛羊猪源性成分检测方法 实时PCR法》同时对市场上40 份牛肉加工品进行检测,结果显示,本方法检测有3 份样品为牛源成分阴性,与SN/T 2051—2008方法检测结果相同。可见,本实验建立的荧光定量PCR方法具有特异、敏感、快速的特点,适用于检测市场中肉类掺假的行为。
关键词:肉制品;牛源性成分;荧光定量PCR;肉类掺假
随着市场上牛肉价格的不断上涨,使其价格远高于其他种属肉制品,部分不法企业及商贩在高成本的牛肉中掺入低廉的其他肉类品种,冒充牛肉进行销售来谋取利益,这种行为在损害消费者利益的同时,也干扰了正常市场竞争秩序的建立
[1-3],造成恶劣的社会影响
[4-6]。因此,建立一种快速、准确检测肉制品中牛肉含量的方法,具有非常重要的意义。对于肉源成分的检测,检疫部门通常采用以线粒体单拷贝基因为基础的荧光定量聚合酶链式反应(polymerase chain reaction,PCR)方法。自Tartaglia等
[7]首先报道了PCR方法检测饲料中的牛、羊源性成分至今,大量研究报道了应用PCR及多重PCR技术对食品中不同肉类种属的鉴别方法
[8-14]。实时荧光PCR技术具有特异性强、敏感性高、操作简便、快速高效等特点,将种属鉴定技术发展到了一个新的高度
[15-18],而探针法荧光定量PCR由于增加了探针结合反应,更进一步增加了该方法的特异性,在肉类掺假检测方面具有巨大的应用潜能。
与线粒体相比,一些管家基因的DNA为单拷贝基因,组织间差异不大
[19],有利于进行量化分析。因此,本研究选用牛β-actin基因组单拷贝基因种间保守片段,设计合成了一对特异性引物与TaqMan探针,构建牛源性成分标准质粒,绘制标准曲线,建立了检测肉制品中牛源性成分定量检测方法,为肉类掺假量化研究的进一步发展提供方法借鉴。
1 材料与方法
1.1 材料与试剂
生鲜牛肉、酱牛肉、肥牛卷、牛肉干、牛肉松、牛排、牛肉馅饺子、猪肉、羊肉、鸡肉、鸭肉、鹅肉均购自郑州市某超市。
组织裂解液、氯仿-异戊醇(24∶1,V/V)、3 mol/L醋酸钠、TE缓冲液均为自配试剂;Tris平衡酚 北京索莱宝生物科技有限公司;Premix Ex 2×Taq
™(Probe qPCR)、pMD-18-T载体、工程菌DH5α感受态细胞 大连宝生物公司;质粒小量制备试剂盒、琼脂糖凝胶快速回收DNA试剂盒 北京百泰生物技术有限公司。
1.2 仪器与设备
ABI 7500实时荧光定量PCR仪 美国应用生物系统(中国)公司;BioSpec-nano微量核酸蛋白仪 日本岛津公司;Z36HK高速冷冻离心机 德国Hermle公司;NTS-4000AM恒温振荡水槽 日本Tokyo Rikakikai公司。
1.3 方法
1.3.1 引物和TaqMan探针
查找Genebank中公布的牛肉单拷贝β-actin基因组的特异区域进行多序列的比对,针对其保守区域设计了牛肉的特异性引物bovine-F、bovine-R和探针bovine-P,并用FAM荧光染料基团标记探针的5’端,非荧光淬灭基团BHQ
1标记探针的3’端,PCR扩增产物长度为96 bp。引物(上海)及探针均由生物工程(上海)技术有限公司合成。
表1 实时荧光PCR引物和探针
Table 1 Primers and probes for flfl uorescence-based PCR
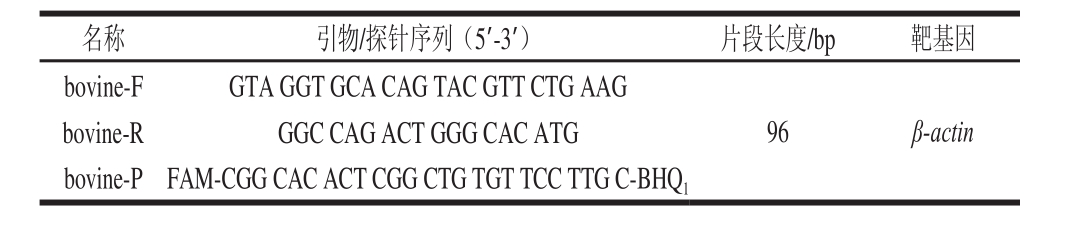
bovine-RGGC CAG ACT GGG CAC ATG bovine-PFAM-CGG CAC ACT CGG CTG TGT TCC TTG C-BHQ
1名称引物/探针序列(5’-3’)片段长度/bp靶基因bovine-FGTA GGT GCA CAG TAC GTT CTG AAG 96 β-actin
1.3.2 样品DNA的提取
肉制品或生鲜样品,取100 mg充分研磨,置于1.5 mL EP管中,加入1 mL ddH
2O,混匀后置-20 ℃反复冻融2 次,5 000 r/min离心3 min,取上清300 μL用于酚-氯仿核酸提取,最后加入50 μL 1×TE缓冲液溶解,作为PCR模板,贮存于-20 ℃备用。
1.3.3 标准质粒的构建
按照琼脂糖凝胶快速回收DNA试剂盒纯化PCR产物,并将其连接到pMD-18-T载体上,转入E.coli工程菌DH5α感受态细胞,并做酶切鉴定,由生物工程(上海)技术有限公司完成测序,并将其命名为pMD-18T-96-beef标准质粒。
1.3.4 牛源性成分荧光定量PCR检测方法反应条件的确定
在Premix Ex Taq™的基础上,选择20 μL的反应体系,对引物和探针浓度进行优化,以最小Ct值和最高荧光增量值为判定依据,从而确定引物和探针的最佳工作浓度。
1.3.5 牛源性成分荧光定量PCR标准曲线的绘制
利用核酸蛋白检测仪检测提取标准质粒的含量,取DNA纯度在1.8~2.0之间的质粒计算其浓度和起始拷贝数,起始模板量为3.32×10
6copies/μL,10倍倍比稀释,共6 个梯度的标准质粒进行荧光定量PCR扩增,绘制荧光定量PCR标准曲线。
1.3.6 牛源性成分荧光定量PCR检测方法的评价
1.3.6.1 灵敏度
设置标准质粒梯度为3.32×10
6、4.76×10
5、3.50×10
4、3.47×10
3、5.13×10
2、4.16×10
1copies/μL,荧光定量PCR能扩增的最低稀释度的拷贝数即为所建方法的灵敏度。
1.3.6.2 特异性
用建立的荧光定量PCR方法分别对猪肉、羊肉、鸡肉、鸭肉、鹅肉基因组进行荧光定量PCR扩增,评价该方法的特异性。
1.3.6.3 重复性
选取4.76×10
5、3.50×10
4、3.47×10
3copies/μL稀释
度的pMD-18T-96-beef标准质粒为模板进行荧光定量PCR扩增,分别做3 次组内重复和组间重复,评价该方法的重复性。
1.3.7 市售牛肉加工品的检测
为验证所建方法在实际样品检测过程中的准确性,购买市售牛肉加工品(酱牛肉、肥牛卷、牛肉干、牛肉松、牛排、牛肉馅饺子等)40 份,按照1.3.2节方法提取DNA模板进行检测。同时用SN/T 2051—2008方法对此40 份样品进行检测,比较2 种方法的符合率。
2 结果与分析
2.1 标准质粒的鉴定
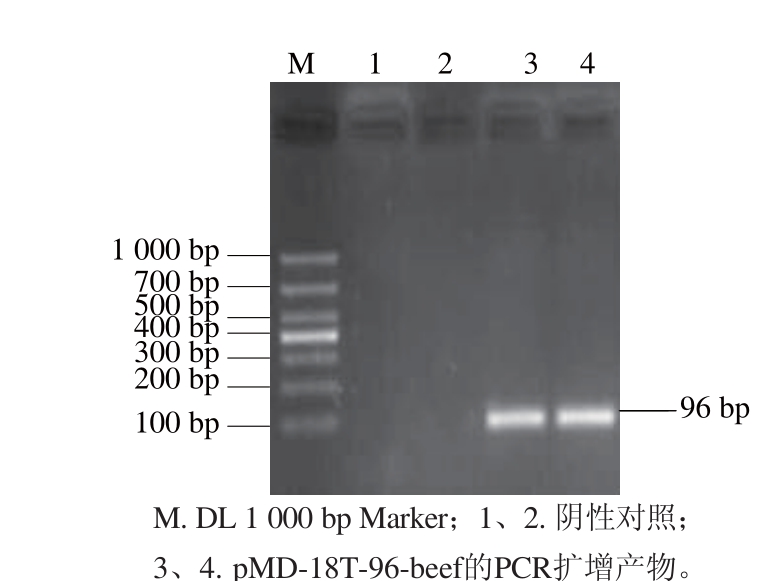
图1 标准质粒pMD-18T-96-beef的PCRR鉴定
Fig.1 PCR identifi cation of standard plasmid pMD-18T-96-beef
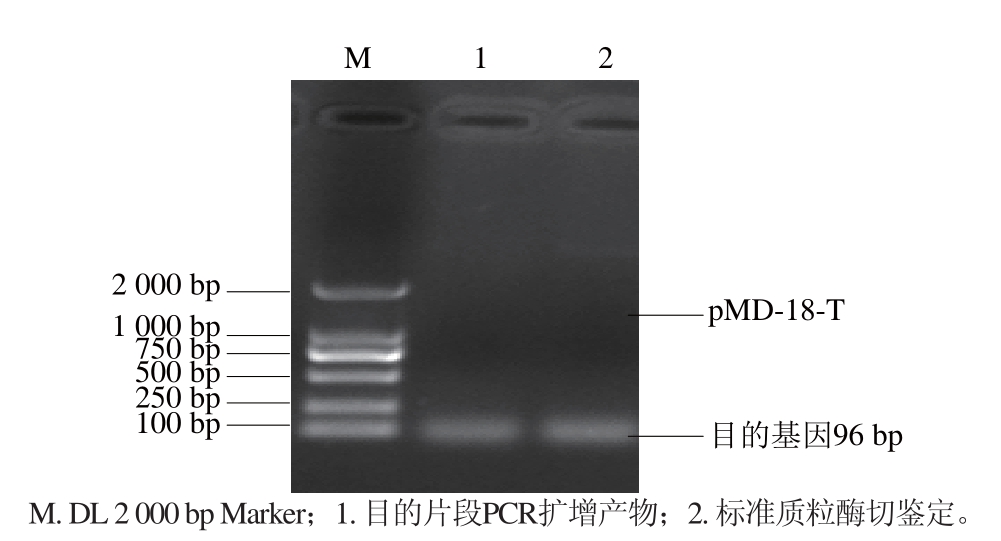
图2 标准质粒pMD-18T-96-beef的酶切鉴定
Fig.2 Enzyme digestion identifi cation of standard plasmid pMD-18T-96-beef
由图1可知,对标准质粒进行PCR鉴定,可扩增到1 条约96 bp的片段,与连接前的PCR产物大小一致。由图2可知,标准质粒酶切鉴定正确,测序结果与后的基因序列相符,表明pMD-18T-96-beef标准质粒构建成功。
2.2 荧光定量PCR反应条件的确定
经过对引物和探针浓度的摸索,确定反应体系为:2×Premix Ex Taq™(Probe qPCR)12.5 μL,bovine-F、bovine-R终浓度为0.5 μmol/L,bovine-P终浓度为0.025 μmol/L,DNA模板2 μL,用双蒸水补齐至20 μL。实时荧光PCR反应条件为:95 ℃/10 s、95 ℃/ 5 s、60 ℃/ 20 s,40 个循环;35 ℃/10 s。结果判定,Ct值<30为阳性,Ct值>40为阴性,两者之间为可疑,重复检验,结果一致且呈明显的对数增长,判定为阳性,否则为阴性。
2.3 牛源性成分荧光定量PCR标准曲线的建立
按优化的反应条件,取6 个稀释度的标准质粒pMD-18T-96-beef作为模板进行荧光定量PCR扩增,从而可以得出拷贝数对数值(x)与循环数(Ct)值之间的线性关系表达式:Ct=-3.345x+36.48,相关系数R
2=0.98。
2.4 牛源性成分荧光定量PCR检测方法的评价
2.4.1 牛源性成分荧光定量PCR检测方法的灵敏度
标准质粒梯度为3.32×10
6、4.76×10
5、3.50×10
4、3.47×10
3、5.13×10
2、4.16×10
1copies/μL时,用荧光定量PCR方法对不同质粒量的模板进行扩增,当标准质粒在4.16×10
1copies/μL模板浓度时,仍然可以检测到牛源性成分阳性,故本检测方法的灵敏度为4.16×10
1copies/μL。
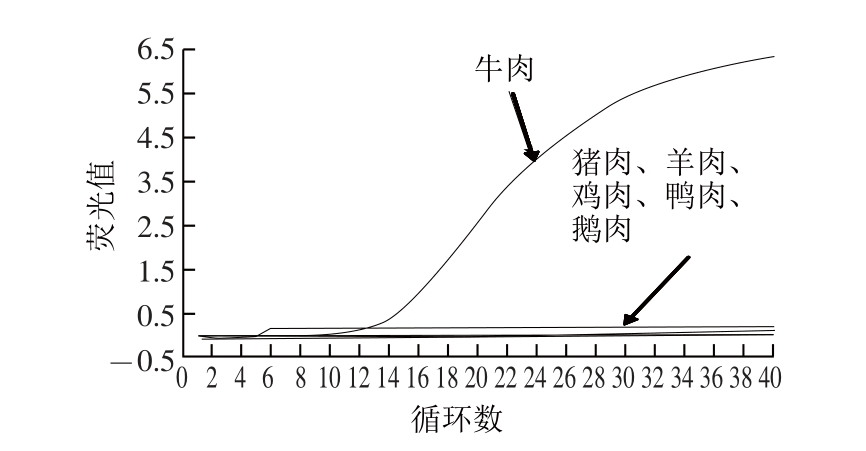
图3 牛源性成分荧光定量PCR特异性实验
Fig.3 Specifi city of the quantitative PCR for detecting bovine-derived ingredients
2.4.2 牛源性成分荧光定量PCR检测方法的特异性以不同肉种基因组为模板进行荧光定量PCR扩增,由图3可知,只有牛肉有荧光信号,猪肉、羊肉、鸡肉、鸭肉、鹅肉均无有效扩增,说明所建方法有很好的特异性。
2.4.3 牛源性成分荧光定量PCR检测方法的重复性
表2 牛源性成分荧光定量PCR重复性实验结果
Table 2 Repeatability of the quantitative PCR
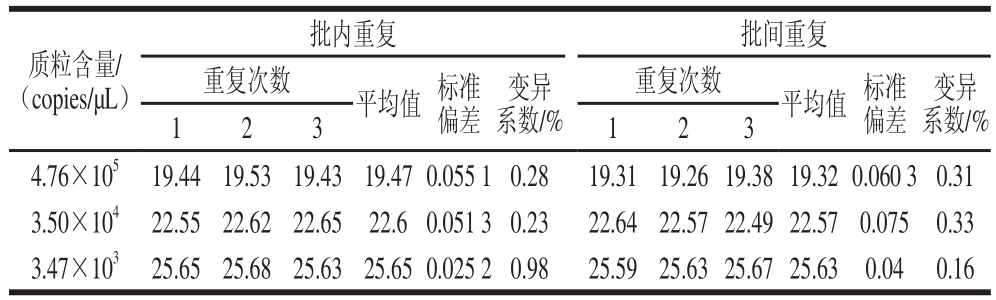
质粒含量/(copies/μL)变异系数/% 123123 4.76×10
519.4419.5319.4319.47 0.055 1 0.2819.3119.26 19.38 19.32 0.060 3 0.31 3.50×10
422.5522.6222.6522.6 0.051 3 0.2322.6422.57 22.49 22.570.0750.33 3.47×10
325.6525.6825.6325.65 0.025 2 0.9825.5925.63 25.67 25.630.040.16批内重复批间重复重复次数平均值标准偏差变异系数/%重复次数平均值标准偏差
由表2可知,4.76×10
5、3.50×10
4、3.47×10
3copies/μL标准质粒稀释度3 次扩增的变异系数均小于0.98%,由批间重复性实验可知,3 个标准质粒稀释度的变异系数均小
于0.33%。可见,本实验建立的荧光定量PCR检测方法具有较高的可重复性,从而保证了样品检测结果的可靠性和稳定性。
2.5 市售样品的荧光定量PCR检测结果
使用本研究建立的方法对40 份市售样品中的牛源性成分进行定量检测,结果显示,有2 份肥牛卷和1 份牛肉干存在检不到荧光信号的现象,表明市场上确实存在假冒牛肉成分的商品。而且该结果与SN/T 2051—2008方法的检测结果符合率达100%。说明本实验建立的荧光定量PCR方法可以用于肉制品中牛源性成分的检测。
3 讨 论
肉类鉴别涉及畜牧业的健康发展,消费者权益的保障,进出口贸易等诸多领域。对肉类鉴别方法的研究十分必要,特别是近几年的核酸扩增技术更给肉类鉴别提供了有利平台。肉类鉴别的靶基因主要包括3 类:线粒体基因组DNA、细胞基因组中重复序列和单拷贝序列。物种基因的正确选择及基因片段长度的大小是动物源性成分检测的关键,本研究选择单拷贝β-actin基因设计特异性引物和探针,是因为其组织间差异不大,在定量检测时更能准确的计算其拷贝数,对其含量进行量化分析。因此单拷贝基因DNA序列已广泛应用于研究物种的遗传分化,物种进化食品及饲料中动物源性成分检测的靶基因
[20]。
本研究基于牛单拷贝基因组序列设计特异性引物和荧光探针,建立了肉制品中牛源性成分检测的TaqMan荧光定量PCR方法。经验证,本研究建立的方法特异性良好,检测灵敏度达到41.6 copies/μL。应用本方法对市售40 份牛肉加工品进行检测,发现确实存在牛肉成分肉类掺假的行为,而且该结果与SN/T 2051—2008方法结果符合率达100%。本研究可以满足日常的检测工作需要,是防止商家掺假牟利的有效手段之一。
荧光定量PCR方法对样品中的牛源性成分进行了相对定量,这方便了食品检测部门对样品中牛源性成分的无意沾染和故意添加做出判定。该方法修补了行业标准的漏洞,是对行业标准的有益补充。应用荧光定量PCR方法检测食品中的牛源性成分是我国行业标准发展的必然趋势,以指导我国食品检验检疫部门对食品的安全进行把关。
应用分子技术来检测食品安全是未来发展的重要方向,肉源成分检测历经了普通PCR方法、实时荧光PCR方法、以及定量PCR方法,虽然各方法还存在着一定的技术性问题,比如后前还不能通过对样品中不同肉源性成分的DNA拷贝数比来计算出其组分的质量比,但是随着分子生物学技术的不断发展必将会日趋完善,在生命科学技术领域有很大的应用前景。
参考文献:
[1] 赵新, 王勇, 兰青阔, 等. 荧光定量PCR方法鉴别肉制品中羊源性成分[J]. 食品工业科技, 2015, 36(1): 299-302.
[2] 张弛, 邱皓璞, 张筠. 实时荧光定量PCR检测肉制品中鸭源性成分[J].食品科学, 2013, 34(18): 154-157.
[3] 李家鹏, 乔晓玲, 田寒友, 等. 食品和饲料中动物源性成分检测技术研究进展[J]. 食品科学, 2011, 32(9): 340-347.
[4] 郑宾. 挂羊头卖鸭肉[J]. 检察风云, 2012(8): 46-47.
[5] 张明, 王冬妍, 杨文奇, 等. 牛羊肉中猪源性成分检测能力验证研究[J].食品安全质量检测学报, 2013, 4(5): 1605-1610.
[6] 王建昌, 王金风, 陈瑞春, 等. 鸭肉冒充牛羊肉的分子生物学检测[J].肉类研究, 2012, 26(6): 20-23.
[7] TARTAGLIA M, SAULLE E, PESTAIOZZA S, et al. Detection of bovine mitochondrial DNA in ruminant feeds: a molecular approach to test for the presence of bovine-derived materials[J]. Journal of Food Protection, 1998, 61(5): 513-518.
[8] MANE B G, MENDIRATTA S K, TIWARI A K. Polymerase chain reaction assay for identification of chicken in meat and meat products[J]. Food Chemistry, 2009, 116(3): 806-810.
[9] DEMARQUOY J. Meat adulteration: the use of PCR[J]. Meat Science, 2013, 94(2): 164.
[10] KARABASANAVAR N S, SINGH S P, KUMAR D, et a1. Detection of pork adulteration by highly-specific PCR assay of mitochondrial D-loop[J]. Food Chemistry, 2014, 145: 530-534.
[11] 赵冉, 蔡振鸿, 陈永锋. 动物产品及饲料中牛源性与羊源性成分三重荧光PCR检测方法的建立[J]. 畜牧与兽医, 2012, 44(7): 18-22.
[12] 胡智恺, 宋丽萍, 姜洁, 等. 实时定量PCR法对牛肉中鸡源成分的量化检测[J]. 食品工业科技, 2014, 35(17): 294-297.
[13] 杨冬艳, 韦梅霞, 杨永存, 等. 多重荧光PCR鉴别羊肉掺假[J]. 中国卫生检验杂志, 2014(2): 555-562.
[14] 郭云霞, 张舒亚, 谌鸿超, 等. SYBR Green实时荧光PCR检测食品中鲨鱼源性成分真实性方法的建立[J]. 食品与生物技术学报, 2012, 31(12): 1300-1306.
[15] ALI M E, HASHIM U, MUSTAFA S, et al. Analysis of pork adulteration in commercial meatballs targeting porcine-specific mitochondrial cytochrome b gene by TaqMan probe real-time polymerase chain reaction[J]. Meat Science, 2012, 91(4): 454-459.
[16] RODRIGUEZ M A, GARCIA T, GONZALEZ I, et al. Quantitation of mule duck in goose foie gras using TaqMan real-time polymerase chain reaction[J]. Journal of Agricultural and Food Chemistry, 2004, 52(6): 1478-1483.
[17] KOPPEL R, DANIELS M, FELDERER N, et al. Multiplex real-time PCR for the detection and quantifi cation of DNA from duck, goose, chicken, turkey and pork[J]. European Food Research and Technology, 2013, 236(6): 1093-1098.
[18] KOPPEL R, RUF J, RENTSCH J. Multiplex real-time PCR for the detection and quantification of DNA from beef, pork, horse and sheep[J]. European Food Research and Technology, 2011, 232(1): 151-155.
[19] TANABE S, MIYAUCHI E, MUNESHIGE A, et al. PCR method of detecting pork in foods for verifying allergen labeling and for identifying hidden pork Ingredients in processed foods[J]. Bioscience, Biotechnology, and Biochemistry, 2007, 71(7): 1663-1667.
[20] 何伟玲, 黄明, 张弛. 食品中肉类成分种属鉴别技术研究进展[J]. 食品科学, 2012, 33(3): 304-307.
Establish and Application of a Real-Time Fluorescence-Based Polymerase Chain Reaction Assay for Detection of Bovine-Derived Materials in Meat Products
MIAO Li
1, LI Zhijuan
2, WANG Shan
2, ZHANG Xiuping
2, CHEN Jing
2
(1.Central Quarantine Laboratory of Henan Entry-Exit Inspection and Quarantine Bureau, Zhengzhou 450003, China; 2.Identifi cation Consulting Center of Henan Inspection and Quarantine, Zhengzhou 450003, China)
Abstract:A real-time fluorescence-based polymerase chain reaction (PCR) assay that enables rapid and accurate identification of adulterated beef products was developed using TaqMan probe for the rapid and effective detection of bovine-derived materials in meat products. A pair of specifi c primers and TaqMan probe was designed according to the conserved sequence of the bovine β-actin gene. PCR reaction conditions were optimized using pMD-18T-96-beef plasmid as standard. The results showed that the pMD-18T-96-beef plasmid was confi rmed to be valid by PCR, sequencing and enzyme digestion and the developed standard curve produced a good linear relationship between Ct value and initial amounts of total DNA with correlation coeffi cient and slope of 0.98 and −3.345, respectively. The sensitivity was 46.1 copies/μL. No cross-reactions were found in specimens containing pork, mutton, chicken, duck and goose. The intra- and inter-assay variable coeffi cients were less than 0.98% and 0.33%, respectively, suggesting good repeatability. A total of 40 beef product samples from the market were measured by this method and the routine real-time PCR method from the industry standard SN/T 2051—2008. Of the 40 samples, 3 were detected as positive as consistently indicated by the two assays. This real-time PCR method with strong specifi city and high sensitivity could provide a useful approach for the identifi cation of meat adulteration.
Key words:meat products; bovine-derived ingredients; fl uorescence-based quantitative polymerase chain reaction; meat adulteration
中图分类号:TS207.3
文献标志码:A
文章编号:1001-8123(2015)09-0030-04
doi:10.15922/j.cnki.rlyj.2015.09.007
收稿日期:2015-04-26
基金项后:国家质检总局科技计划项后(2014IK089)
作者简介:苗丽(1971—),女,高级兽医师,硕士,研究方向为分子生物学及食品微生物学。E-mail:ml5628@163.com




