
图1 不同加热温度和处理时间对鸡爪胶原纤维超微结构的影响
Fig.1 Ultrastructure of collagen fi bers at different heating temperatures and processing times
高伟伟 1,霍香如 1,李桂霞 1,韦永可 1,朱 杰 1,2, *
(1.西北农林科技大学理学院,生物物理研究所生物力学与工程研究室,陕西 杨凌 712100;2.西北农林科技大学,中美食品安全联合研究中心,陕西 杨凌 712100)
摘 要:研究不同温度和时间条件处理对鸡爪筋胶原纤维超微结构的影响。加热组将新鲜鸡爪筋剪碎匀浆后分别在50、60、70 ℃条件下水浴加热10、20、30 min;冻藏组将新鲜鸡爪筋分别在-20、-80 ℃条件下冻藏5、10、15 d,通过对处理后的样品采用原子力显微镜扫描成像的方法研究鸡爪筋在不同温度及时间处理后的胶原纤维周期长度和粗糙度的变化。结果表明:胶原纤维周期长度随加热温度升高、加热时间增长而变短,随冻藏温度降低,冻藏时间的延长而变长,其中60、-20℃变化最典型。60 ℃时,当加热时间由10 min增至30 min,周期长度由(72.20±2.58)nm减至(71.00±1.78)nm;-20℃时,当冻藏时长由5 d增至15 d,周期长度由(69.70±2.60)nm增至(73.00±2.90)nm。冻藏时间增加,鸡爪筋胶原纤维表面的粗糙度增加;加热时间增加,50 ℃加热时,鸡爪筋胶原纤维的粗糙度先增后减;60 ℃加热则与之相反。
关键词:原子力显微镜;加热;冻藏;鸡爪;胶原纤维;超微结构
鸡爪是肉鸡宰杀后的一种副产品,近年来以鸡爪为原材料开发的产品深受欢迎,如卤鸡爪、炸鸡爪、泡鸡爪等 [1]。热处理是一种常见的肉制品熟化和杀菌方法,不同热处理方式和温度对鸡爪品质有显著的影响 [2]。肉在加热过程中发生了大量的物理和生化反应,诸多品质也随之变化显著 [3],其中胶原蛋白的变化尤为重要。加热过程中蛋白质的热变性是引起胶原蛋白构造变化的主要原因 [4]。
由于鸡爪是富含胶原的食品,因此具有较高的营养价值和较好的口感。但鸡爪在常温下放置时间过长易变味 [5],所以需要进行冻藏保藏。低温贮藏作为食品的主要保鲜方法 [6],广泛应用于各种食品的保鲜,胶原蛋白与肉的质地口感有很大相关性,因此,研究胶原蛋白在低温贮藏下的变化对于保证肉的质地口感有着重要意义。经研究,胶原蛋白在冻藏过程中会发生降解 [7],溶解性的改变会导致肉质的改变。并且现有研究认为,提高冻藏速率和降低贮藏温度能够提高肉的质量 [8-9]。
无论采用哪种处理技术,往往都要通过检测胶原纤维结构和力学特性来反映最终的处理效果。Binnig等 [10]发明的原子力显微镜(atomic force microscope,AFM)放大倍数(10 9倍)远超以往的任何显微镜 [11],AFM是一种具有原子级高分辨的新型仪器 [12],既能够实现对细胞与生物大分子的纳米级分辨成像,又能实现微观局部力学特性的检测,非常适合胶原纤维纳米结构和力学特性的研究。
本研究通过对鸡爪筋进行不同时间的加热和冻藏处理,经剪碎、匀浆、离心后制样,用原子力显微镜扫描胶原纤维的结构变化规律以及总体纤维形态的分布,找到温度及作用时间对鸡爪筋的影响。
1.1 材料
新鲜鸡爪购于杨凌高新农业示范区康乐市场。将新鲜鸡爪解剖取出其内部筋腱,蒸馏水清洗,分割成1.5 cm的小段,每一段作为一个样品用量。
1.2 仪器与设备
Multimode-8型(Nanoscope V)原子力显微镜、SCANASYST-AIR型探针(探针材料为氮化硅)、微悬臂(T=650 nm、L=115 μm、W=25 μm、f 0=70 kHz、k=0.4 N/m) 美国Bruker公司。
1.3 方法
1.3.1 样品处理
加热组:将分割后的鸡爪筋腱用剪刀剪碎,装于10 mL玻璃管中,在50、60、70 ℃条件下分别进行水浴加热10、20、30 min,将加热后的鸡爪筋腱在匀浆机下间歇匀浆直到鸡爪筋腱被打散,然后用离心机在3 000 r/min下离心2次,每次2 min,除去部分可溶性杂质,最后将得到的样品加1.5 mL蒸馏水混匀。用移液枪吸取20 μL点样于新鲜解理的云母片,室温晾干后用移液枪吸取蒸馏水逐滴冲洗样品,将冲洗过后的云母片用双面胶粘在金属台上,于原子力显微镜下扫样成像 [13]。
冻藏组:分割好的鸡爪筋腱于-20、-80 ℃条件下分别冻藏5、10、15 d,将冻藏到期的鸡爪筋腱取出后用剪刀机械剪碎,后续步骤同加热组。1.3.2 AFM成像 [14-17]
所有测试均在原子力显微镜上完成。AFM采集样品表面信息通过一端装有该探针的微悬臂完成。当针尖与样品接近时,此AFM可以通过ScanAsyst智能成像模式,对样品进行图像采集。
1.4 数据处理
将原子力显微镜扫描得到的高度图,使用软件Nano Scope Analysis(Version 1.10)统计数据 [18-19]。实验测定周期长度(D)、均方根(R ms)、R z(在一个取样长度内,5 个最大轮廓峰高之和与5 个最大轮廓谷深之和的差值的平均值)的相关数据,并用Excel整理数据,分析结果以平均值±标准差表示。
2.1 加热和冻藏处理后鸡爪筋胶原纤维周期变化

图1 不同加热温度和处理时间对鸡爪胶原纤维超微结构的影响
Fig.1 Ultrastructure of collagen fi bers at different heating temperatures and processing times
由图1可知,经不同时间和温度处理后的鸡爪筋的微观结构发生改变,经AFM扫描可发现鸡爪筋表面的胶原纤维周期结构和粗糙度都有改变。加热组,随着加热时间和温度的增加,胶原纤维的周期结构发生改变,未经任何处理的胶原纤维周期长度为(72.40±2.74)nm。50 ℃加热时,加热10、20、30 min后胶原纤维的周期长度分别为(72.30±1.63)、(72.20±0.83)、(71.80±1.19)nm;60 ℃加热时,加热10、20、30 min后胶原纤维的周期长度分别为(72.20±2.58)、(71.70±3.46)、(71.00±1.78)nm;70 ℃加热10 min后,周期长度为(71.10±3.90)nm。70 ℃加热20、30 min,胶原纤维结构已被严重破坏,整体纤维分布不再规则,已经明胶化。

图2 不同冻藏温度和处理时间对鸡爪胶原纤维超微结构的影响
Fig.2 Ultrastructure of collagen fi bers at different frozen temperatures and storage times
由图2可知,-20 ℃冻藏时,冻藏5、10、15 d后胶原纤维的周期长度分别为(69.70±2.60)、(71.70±1.50)、(73.00±2.90)nm;-80 ℃冻藏时,冻藏5、10、15 d后胶原纤维的周期长度分别为(69.80±2.90)、(71.40±2.40)、(72.00±1.60)nm。
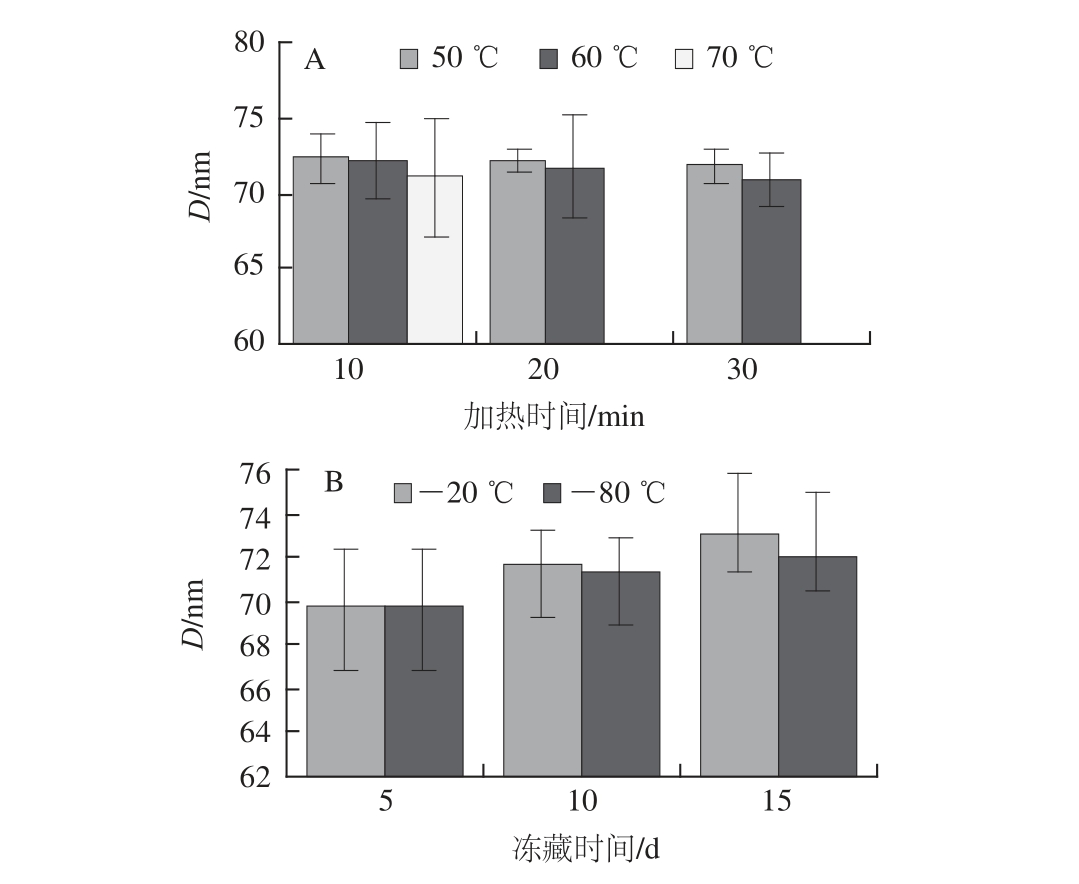
图3 加热(A)与冻藏(B)过程中鸡爪胶原纤维周期长度的变化规律
Fig.3 Changes in D-spacing length of collagen fi bers during heating (A) and freezing (B)
由图3可知,相同加热温度下,加热时间越长,胶原纤维的周期长度越短;相同加热时间,加热温度越高,胶原纤维的周期长度越短。相同冻藏温度下,冻藏时间越长,胶原纤维的周期长度越长;相同冻藏时间,冻藏温度越低,胶原纤维周期长度越短。
2.2 加热和冻藏处理后鸡爪筋胶原纤维粗糙度变化
2.2.1 冻藏组R z、R ms变化
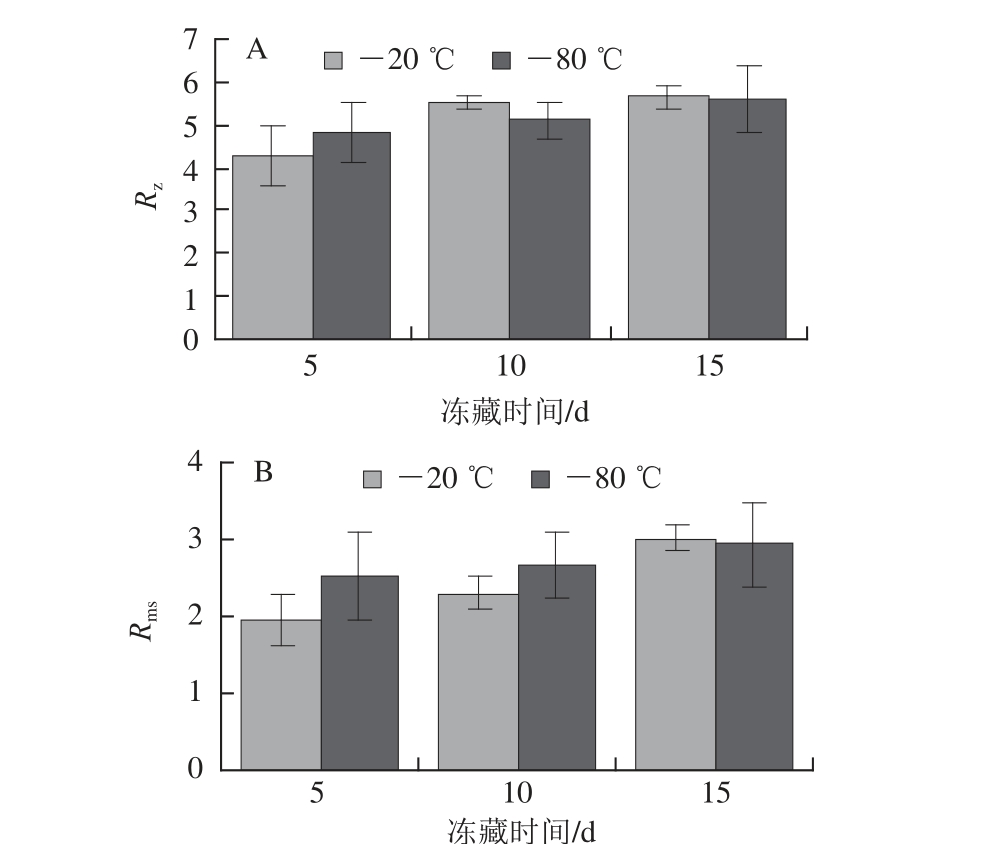
图4 冻藏组R
z(A)和R
ms(B)的变化规律
Fig.4 Changes of R
z(A) and R
ms(B) among frozen groups
由图4可知,随着冻藏时间的不断增加,-20℃和-80℃冻藏的鸡爪筋胶原纤维的R z、R ms值均呈现规律性变化。冻藏时间越长,R z、R ms值越大。-20℃冻藏5、10、15 d胶原纤维的R z值分别为(4.28±0.72)、(5.55±0.15)、(5.64±0.30)nm;R ms值分别为(1.97±0.33)、(2.31±0.22)、(3.01±0.16)nm。
-8 0℃冻藏5、1 0、1 5 d胶原纤维的R z值分别为(4.79±0.70)、(5.11±0.41)、(5.58±0.80)nm;R ms值分别为(2.54±0.58)、(2.66±0.44)、(2.93±0.57)nm。R z和R ms的增加说明,随着冻藏时间的增加,鸡爪筋胶原纤维表面的粗糙度增加。
2.2.2 加热组R z、R ms变化
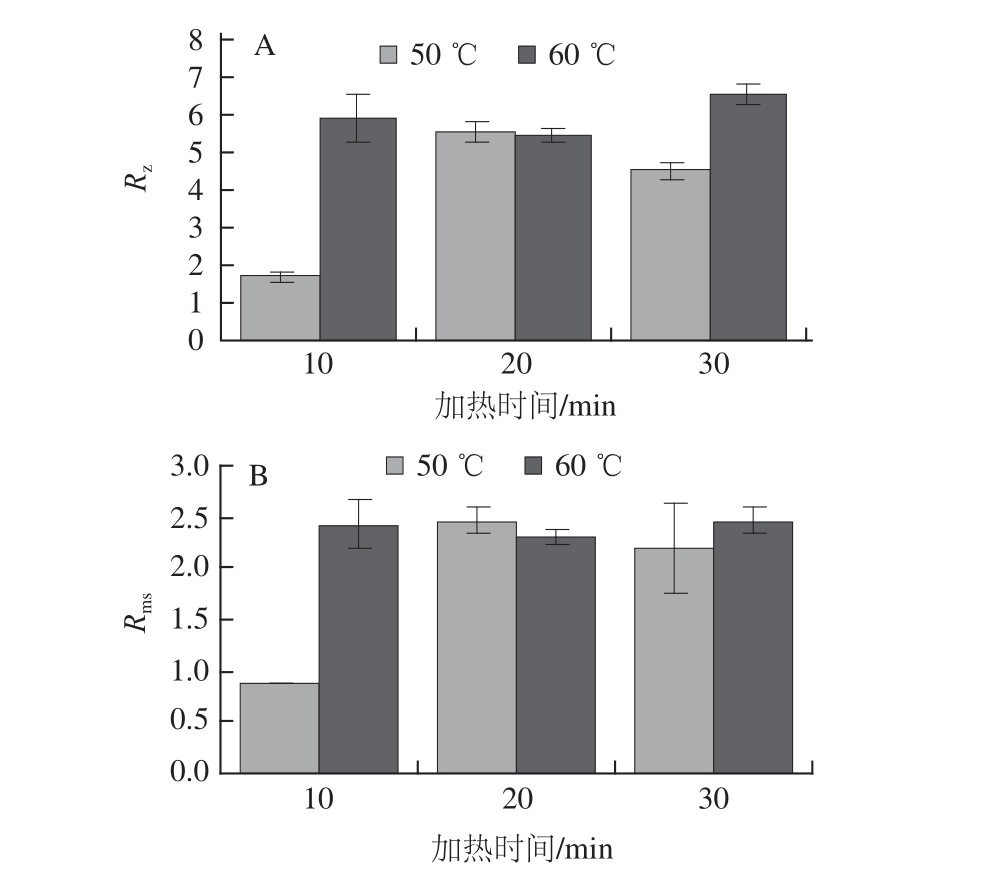
图5 加热组R
z(A)和R
ms(B)变化规律
Fig.5 Changes in R
z(A) and R
ms(B) during heating
由图5可知,50 ℃和60 ℃加热条件下胶原纤维的R z、R ms值呈现相同变化规律。50 ℃加热10、20、30 min胶原纤维的R z值分别为(1.70±0.15)、(5.58±0.27)、(4.51±0.22)nm;R ms值分别为(0.87±0.00)、(2.47±0.141)、(2.20±0.45)nm。60℃加热10、20、30 min胶原纤维的R z值分别为(5.90±0.67)、(5.46±0.15)、(6.57±0.30)nm;R ms值分别为(2.42±0. 23)、(2.31±0.06)、(2.45±0.13)nm。50 ℃加热时,随着加热时间的增加,鸡爪筋胶原纤维样品的R z、R ms都是先上升后下降;60 ℃加热时,随着加热时间的增加,鸡爪筋胶原纤维样品的R z、R ms的参数值都是先下降后上升。R z和R ms的变化趋势说明:50 ℃加热时,随加热时间的增加,鸡爪筋胶原纤维的粗糙度先增加后减小;60 ℃加热时,随加热时间的增加,鸡爪筋胶原纤维的粗糙度先减小后增加。
用AFM对加热和冻藏处理后的鸡爪胶原纤维进行清晰的成像,从而对不同处理条件下鸡爪胶原纤维的周期长度进行了界定,并通过分析同一温度不同时长的处理结果得知,在鸡爪胶原纤维的加热过程中,胶原纤维发生了皱缩形变致使胶原纤维的周期缩短;而在冻藏过程中,胶原纤维则发生了拉伸形变致使周期增长。该实验已基本得出加热与冻藏过程对鸡爪胶原纤维周期长度的影响。冻藏组的R z和R ms的变化说明,冻藏处理的时间越长,鸡爪筋胶原纤维表面粗糙度增大;加热组中50 ℃加热时,随着加热处理的时间变长,鸡爪筋胶原纤维表面粗糙度先增大后减小;60 ℃加热时,随着加热处理时间变长,鸡爪筋胶原纤维表面粗糙度先减小后增大。
AFM在数据处理上存在一定的不足,主要表现在样品或空气中的污染物质会在探针和样品相互作用时粘附到探针上,从而在AFM成像时对胶原纤维样品表面形态的测量产生干扰 [20],影响数据的分析,使误差增大。但相比其他传统的鸡爪筋胶原纤维的显微图片,AFM的显微系统对于加热及冻藏处理后鸡爪筋胶原纤维的形变可以进行更好的量化处理,这使得此次实验处理具有更好的直观性。同时,AFM技术及其辅助技术分辨率在侧向上可达到0.1 nm,竖直方向上可达到0.01 nm [21],这也提高了此次实验结果的可靠性,该技术为肉品质的评测及微观测量技术提供了极有用的方向及指导。
参考文献:
[1] 豆成林, 王清, 吴振业, 等. 无骨泡椒鸡爪的研制[J]. 现代食品科技, 2013, 29(5): 1072-1075.
[2] 常海军, 曹莹莹, 王强, 等. 不同热处理方式和温度对牛半腱肌肉品质的影响[J]. 食品科学, 2010, 31(11): 42-46.
[3] 李超, 徐为民, 王道营, 等. 加热过程中肉嫩度变化的研究[J]. 食品科学, 2009, 30(11): 262-265.
[4] 高昕, 刘莲凤, 刘倩, 等. 不同加热温度下刺参肌肉组织与胶原纤维结构的变化[J]. 水产学报, 2012, 36(9): 1465-1471.
[5] 吴荣书. 腌鸡爪的加工及保存期的研究[J]. 食品研究与开发, 2003, 24(6): 27-28.
[6] 黄海, 曾名勇. 鳙鱼肌肉胶原蛋白在低温贮藏中的变化[J]. 食品研究与开发, 2009, 30(12): 21-25.
[7] 张一江, 黄海. 不同冻藏温度下鲫鱼肌肉胶原蛋白[J]. 食品科技, 2008, 33(12): 103-106.
[8] 余小领, 李学斌, 闫利萍, 等. 不同冻结和解冻速率对猪肉保水性和超微结构的影响[J]. 农业工程学报, 2007, 23(8): 261-265.
[9] BOLES J A, SWAN J E. Effect of post-slaughter processing and freezing on the functionality of hot-boned meat from young bull[J]. Meat Science, 1996, 44(1/2): 11-18.
[10] BINNIG G, QUATE C F, GERBER C. Atomic force microscope[J]. Physical Review Letter, 1986, 56(9): 930-933.
[11] 朱杰, 郭连红, 王国栋, 等. 原子力显微镜在细胞与生物大分子超微结构和力学研究中的应用[J]. 医用生物力学, 2012, 27(3): 355-360.
[12] DING C, ZHANG M, WU K, et al. The response of collagen molecules in acid solution to temperature[J]. Polymer, 2014, 55(22): 5751-5759.
[13] 王子仪, 张荣君, 郑玉祥, 等. AFM扫描参数对样品粗糙度测量的影响[J]. 实验室研究与探索, 2013, 32(2): 5-7.
[14] 吴敏, 朱杰, 贾明明, 等. 钙离子与氧自由基诱导损伤猪心肌细胞线粒体超微结构观察[J]. 动物医学进展, 2014, 35(5): 62-67.
[15] CHANG Haijun, WANG Qiang, XU Xinglian, et al. DSC analysis of heat induced changes in thermal characteristics of connective tissue collagen from beef semitendinosus muscle[J]. Food Science, 2011, 32(13): 49-53.
[16] MÜLLER D J, HARALD J, TIINA L, et al. Observing structure, function and assembly of single proteins by AFM[J]. Progress in Biophysics & Molecular Biology, 2002, 79(1/3): 1-43.
[17] MÜLLER D J, KURT A. Biomolecular imaging using atomic force microscopy[J]. Trends Biotechnol, 2002, 20(8): 45-49.
[18] RIBEIRO N, SOUSA S R, van BLITTERSWIJK C A, et al. A biocomposite of collagen nanofi bers and nanohydroxyapatite for bone regeneration[J]. Biofabrication, 2014, 6(3): 035015.
[19] KAHN C J, DUMAS D, ARAB-TEHRANY E, et al. Structural and mechanical multi-scale characterization of white New-Zealand rabbit achilles tendon[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2013, 26: 81-89.
[20] ZHU Jie, SABHARWAL T, GUO Lianhong, et al. Effects of probe pollutants on morphological and mechanical measurements of muscle and collagen fi bers using atomic force microscopy[J]. Scanning, 2010, 32(3): 113-121.
[21] 朱杰, 王国栋. 原子力显微镜在ATP合成酶超分子结构及功能表征中的应用[J]. 高分子材料科学与工程, 2007, 23(3): 16-20.
Effects of Heating and Frozen Storage on Ultrastructure of Collagen Fibers from Chicken Claw
GAO Weiwei
1, HUO Xiangru
1, LI Guixia
1, WEI Yongke
1, ZHU Jie
1,2,*
(1. Laboratory of Biomechanics and Engineering, Institute of Biophysics, College of Science, Northwest A&F University, Yangling 712100, China; 2. Sino-US Joint Center of Food Safety, Northwest A&F University, Yangling 712100, China)
Abstract:The main objective of this study was to explore the effects of different temperatures and treatment times on ultrastructure of collagen fi bers from chicken claw. In the heated group, fresh samples were heated in water of 50, 60 and 70 ℃for 10, 20 and 30 minutes respectively; in the frozen group, samples were frozen in −20 and −80 ℃ for 5, 10 and 15 days respectively. By scanning the samples via atomic force microscopes, the experiment was intended to examine the changes in D-spacing length and roughness of collagen fiber under different treatments. The results show that with the heating temperature rising and processing time becoming longer, the D-spacing length of collagen fi ber grew shorter, and it grew longer when the frozen temperature decreased and storage time was extended. Samples at 60 and −2 0 ℃ showed the most signifi cant changes. At 60 ℃, D-spacing length reduced from (72.20 ± 2.58) to (71.00 ± 1.78) nm (n =10) with processing time increasing from 10 to 30 min; at −20 ℃, it increased from (69.70 ± 2.60) to (73.00 ± 2.90) nm (n =10) as storage time increased from 5 to 15 days.With the frozen time increasing, the surface roughness of collagen fi bers from chicken claw increased. At 50 ℃, with the heating time increasing, the roughness increase fi rstly and then decrease. The contrary changes in roughness change were observed for heating at 60 ℃.
Key words:atomic force microscope; heating; frozen storage; chicken claw; collagen fi ber; ultrastructure
中图分类号:TS251.5
文献标志码:A
文章编号:1001-8123(2015)08-0013-04
doi:10.7506/rlyj1001-8123-201508004
收稿日期:2015-04-17
基金项目:国家自然科学基金青年科学基金项目(11202170;11491240102);陕西省自然科学基金项目(2015JQ1005);西北农林科技大学大学生创新训练计划项目(2014XZ21)
作者简介:高伟伟(1992—),女,硕士研究生,主要从事生物力学工程研究。E-mail:540167731@qq.com
*通信作者:朱杰(1980—),男,副教授,博士,主要从事生物力学工程研究。E-mail:jiezhu@nwafu.edu.cn