多壁碳纳米管分散固相萃取结合LC-MS-MS测定鸡肉中金刚烷胺
孙亚米
1,刘勇军
2,赵 健
1,叶宇飞
1,吕 燕
1,吴银良
1,*
(1.宁波市农业科学研究院,浙江 宁波 315040;2.中国动物疫病预防控制中心,北京 100125)
摘 要:建立了采用多壁碳纳米管为吸附剂的分散固相萃取净化、液相色谱串联质谱测定鸡肉中金刚烷胺残留量的方法。鸡肉样品经乙酸乙腈提取后,调节pH值至11,加入75 mg 多壁碳纳米管进行分散固相萃取,被吸附的药物经5.0%甲酸溶液:甲醇(5∶5,V/V)洗脱,洗脱液过滤膜后直接进样分析。采用Acquity UPLC BEH C
18色谱柱分离,以0.1%甲酸水溶液和甲醇作为流动相作梯度洗脱,电喷雾正电子(ESI
+)模式电离,多反应监测模式检测,内标法校准进行定量。金刚烷胺在0.05~5.0 μg/L质量浓度范围内呈良好的线性,线性相关系数均大于0.99,鸡肉样品中最低定量限为0.50 μg/kg。鸡肉样品中添加0.5~1.0 μg/kg金刚烷胺的回收率在97.8%~103.6%之间,相对标准偏差均小于10%。
关键词:金刚烷胺;液相色谱串联质谱法;多壁碳纳米管;分散固相萃取
金刚烷胺(amantadine)最早用于抑制人类流感病毒的抗病毒药,同时也是帕金森综合症的治疗药物。但金刚烷胺对食用者可能产生嗜睡、失眠、眩晕、抑郁、恶心、食欲减退等多种不良反应,具有一定的毒副作用。在畜牧养殖上,金刚烷胺主要用于鸡禽流感的预防和早期治疗,以及猪传染性胃肠炎的防治,但长期使用金刚烷胺会使病毒产生耐药性,因此美国食品与药品监督管理局(Food and Drug Adminitration,FDA)已明确禁止在畜禽养殖中使用此类药物
[1]。我国农业部也于2005年发布了《关于清查金刚烷胺等抗病毒药物的紧急通知》,明令禁止金刚烷胺类抗病毒药物用于畜禽养殖业
[2]。然而目前我国畜禽饲养中滥用金刚烷胺现象依然存在,为保障公众身体健康,急需建立动物性食品中快速、灵敏和准确的金刚烷胺残留量分析方法。
对于金刚烷胺类药物残留量的分析,在该类药物禁止在动物生产中使用前样品主要是生物体液,如血浆和尿液等。分析手段主要有气相色谱(gas chromatography,GC)法
[3]、液相色谱(liquid chromatography,LC)法
[4-7]、毛细管电泳(capillary zone electrophoresis,CZE)法
[8]、液相色谱-质谱(liquid chromatography mass spectrometry,LC-MS)和液相色谱串联质谱(liquid chromatography tandem mass spectrometry,LC-MS-MS)法
[9-12]等。近年来,对于动物性食品中金刚烷胺残留量的分析已有一些报道
[13-20],但这些方法的前处理方法通常仍采用传统的固相萃取手段,前处理相对较复杂。近年来碳纳米管(carbon nanotubes,CNTs)材料作为固相萃取填料在农兽药残留分析中有一定的应用,但作为分散固相萃取(dispersive solid phase extraction,dSPE)材料在农兽药残留分析,特别是兽药残留分析中应用非常少,至今尚未有关CNTs在金刚烷胺类药物分析中的应用。因此本研究就多壁碳米管(multi-walled carbon nanotubes,MWCNTs)作为dSPE材料对鸡肉中金刚烷胺的净化方法进行了研究,在优化净化前提取液pH值、MWCNTs种类和用量以及吸附时间的基础上建立了操作简便、灵敏度和重复性均较好的LC-MS-MS分析方法。
1 材料与方法
1.1 材料与试剂
鸡肉样品 市购。
盐酸金刚烷胺 美国Sigma-Aldrich公司;盐酸金刚烷胺-d
15标准品 加拿大Toronto Research Chemicals公司;甲醇(色谱纯)、乙腈(色谱纯) 美国默克公司;其他试剂均为分析纯试剂。MWCNT01(外径<8 nm,长度10~30 μm),MWCNT02(外径10~20 nm,长度10~30 μm),MWCNT03(外径20~30 nm,长度10~20 μm),MWCNT04(外径30~50 nm,长度10~30 μm)和MWCNT05(外径>50 nm,长度10~20 μm) 南京先锋纳米材料科技有限公司。MWCNT01-05的比表面积依次为500、200、110、60 m
2/g和40 m
2/g。
1.2 仪器与设备
UPLC Xevo
TMTQ MS超高效液相色谱串联质谱仪美国Waters公司;SIGMA3K15离心机 北京博励行有限公司;Milli-Q超纯水仪 美国Millipore公司。
1.3 方法
1.3.1 标准溶液的配制
1.3.1.1 标准储备液
称取金刚烷胺和金刚烷胺-d
15标准品各10.0 mg,分别用乙腈定容至刻度,即成质量浓度为100 mg/L的标准储备液,―18 ℃条件下保存,保质期6 个月。
1.3.1.2 标准工作液
用0.1%甲酸水/甲醇(7∶3,V/V)稀释金刚烷胺标准储备液配制质量浓度分别为0.05、0.20、0.50、1.0、2.0 μg/L和5.0 μg/L的标准工作液,各标准工作液中加1.0 μg/L金刚烷胺-d
15,现配现用。
1.3.2 样品前处理
称取鸡肉样品2.0 g,加入50 μL质量浓度400 μg/L的内标工作液,混匀后加入10 mL体积分数为1.0%乙酸乙腈溶液,以10 000 r/min速度匀质1 min,再以9 500 r/min离心3 min,收集上清液。取2 mL上清液转入50 mL塑料离心管中,加超纯水18 mL进行稀释后调节pH 11.0,加入75 mg MWCNTs,涡旋5 min,9 500 r/min离心3 min,弃去上清液,最后加入4 mL 体积分数5.0%甲酸溶液:甲醇(5∶5,V/V),涡旋1 min后以9 500 r/min离心2 min,吸取上清液过0.22 µm滤膜后供LC-MS-MS分析。
1.3.3 仪器条件
1.3.3.1 液相色谱条件
色谱柱A c q u i t y U P L C B E H C
1
8色谱柱(100 mmh 2.1 mm,1.7 μm);流动相:0.1%甲酸水(A)-甲醇(B)(梯度洗脱);梯度洗脱程序:0~1.0 min,30%甲醇;1.0~3.0 min,30%~70%甲醇,保持0.5 min;3.5~3.6 min,70%~30%甲醇;再保持1.4 min。流速0.3 mL/min,柱温35 ℃;进样量10 μL。
1.3.3.2 质谱条件
质谱条件优化时采用1 000 μg/L的金刚烷胺和金刚烷胺-d
15标准工作溶液,利用IntelliStart软件进行优化。
电离模式:电喷雾电离(electrospray ionization,ESI)源正离子模式;多级反应检测(multiple reaction monitoring,MRM);毛细管电压1.0 kV;萃取锥孔电压30 V;RF透镜电压0.5 V;离子源温度150 ℃;脱溶剂气温度500 ℃;锥孔气流速50 L/h;脱溶剂气流速1 000 L/h;倍增器电压650 V;二级碰撞气:氩气;各物质的定性定量离子对等参数详见表1。
表1 金刚烷胺和金刚烷胺-d
15的定性、定量离子对、锥孔电压及碰撞能量
Table 1 Qualitative ion pair, quantitative ion pair, cone voltage and collision energy for amantadine and amantadine-d
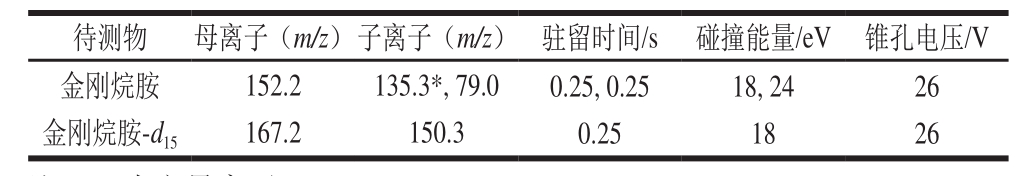
注:*.为定量离子。
26 26待测物母离子(m/z)子离子(m/z)驻留时间/s碰撞能量/eV锥孔电压/V金刚烷胺金刚烷胺-d
15152.2 167.2 135.3*, 79.0 150.3 0.25, 0.25 0.25 18, 24 18
2 结果与分析
2.1 仪器条件的选择
目前发表的有关金刚烷胺类药物的LC-MS-MS方法均采用电喷雾正离子(ESI
+)模式监测。本研究利用IntelliStart软件在蠕动泵以20 μL/min流速下对金刚烷胺和金刚烷胺-d
15的质谱条件进行了优化,所有选择的离子对(表1)在实际样品分析时均不存在干扰。
在用LC-MS-MS分析时,流动相的组成和配比不但会影响目标化合物的色谱行为,还会影响到目标化合物的离子化效率,从而影响灵敏度。实验选择Acquity UPLC BEH C
18柱为分离柱,发现在正离子模式和同样的梯度条件下,采用0.1%甲酸溶液/甲醇作为流动相,金刚烷胺和金刚烷胺-d
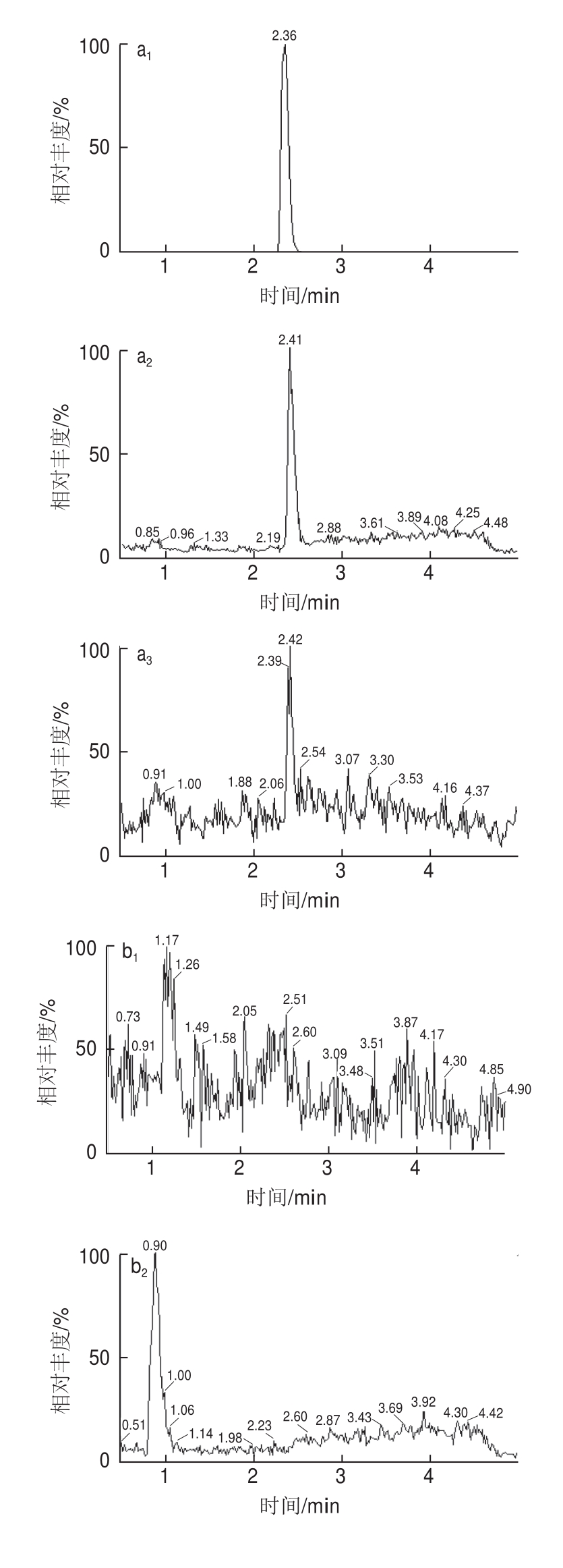
15的响应明显较0.1%甲酸溶液/乙腈作为流动相时高,因此本实验中选择0.1%甲酸溶液/甲醇作为流动相。经上述仪器条件得到的标准工作液图谱(图1),图1中可见金刚烷胺峰形良好。
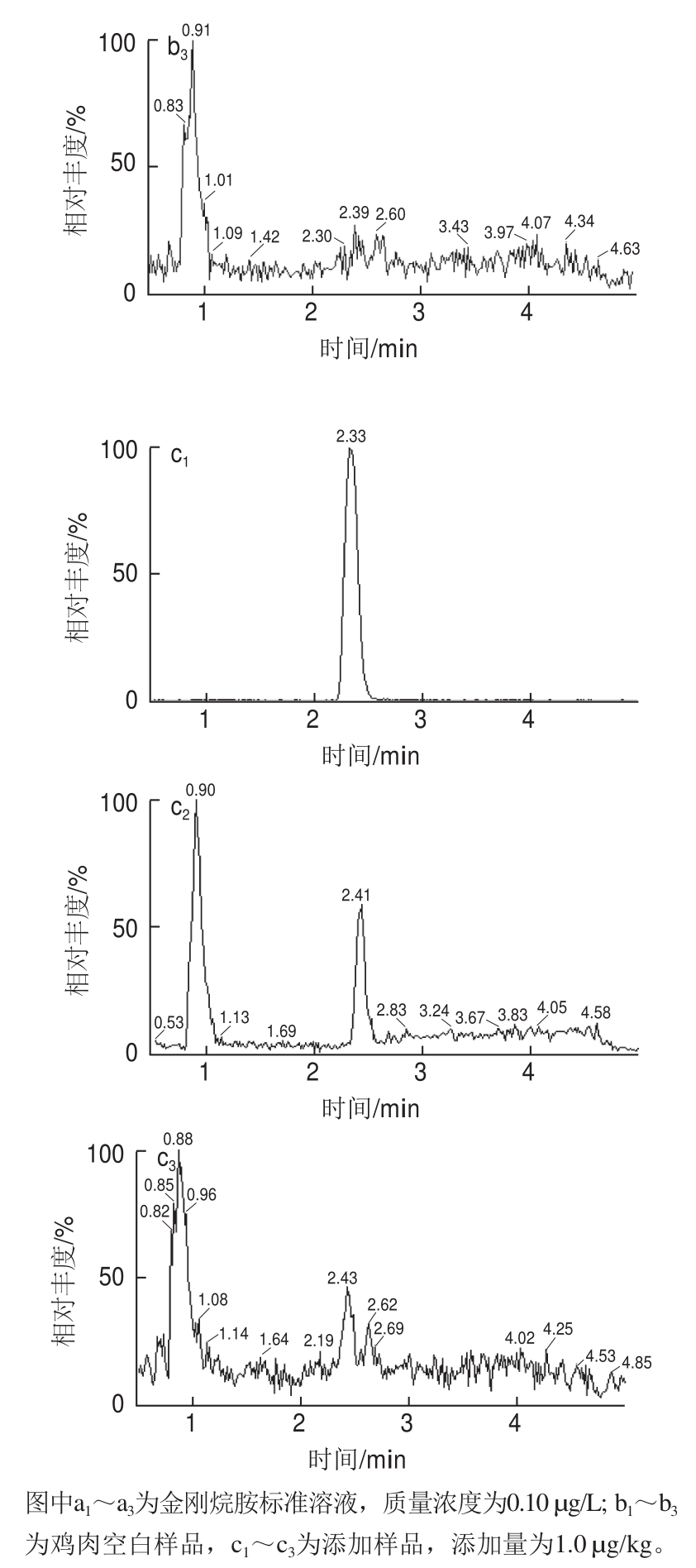
图1 金刚烷胺标准溶液、鸡肉空白样品和添加样品MRM色谱图
Fig.1 MRM chromatograms of a working standard solution, blank chicken muscle sample and a fortified blank chicken muscle sample
2.2 提取溶剂的选择
甲醇和1.0%乙酸乙腈曾被用来提取鸡组织中的金刚烷胺,为简化提取步骤,实验对2 g鸡肉用10 mL甲醇或10 mL体积分数为1.0%乙酸乙腈分别提取1次,结果发现对甲醇对金刚烷胺的提取回收率只有62.1%;而1.0%乙酸乙腈的提取回收率则达到了85.3%,因此本实验选择1.0%乙酸乙腈作为提取剂。
2.3 dSPE条件优化
2.3.1 MWCNT种类选择
实验利用同样质量(100 mg)的5 种MWCNT对经超纯水稀释后的提取液进行金刚烷胺吸附回收率实验。如图2所示,同一条件下比表面积较高的MWCNT回收率对金刚烷胺的吸附回收率较高;同时随着溶液中水相比例的增高,5 种MWCNT对金刚烷胺的吸附回收率明显增高,因此实验选择比表面积最大(MWCNT01)和超纯水:提取液比例为1∶9进行实验。2.3.2 MWCNT用量选择和稀释液pH值优化
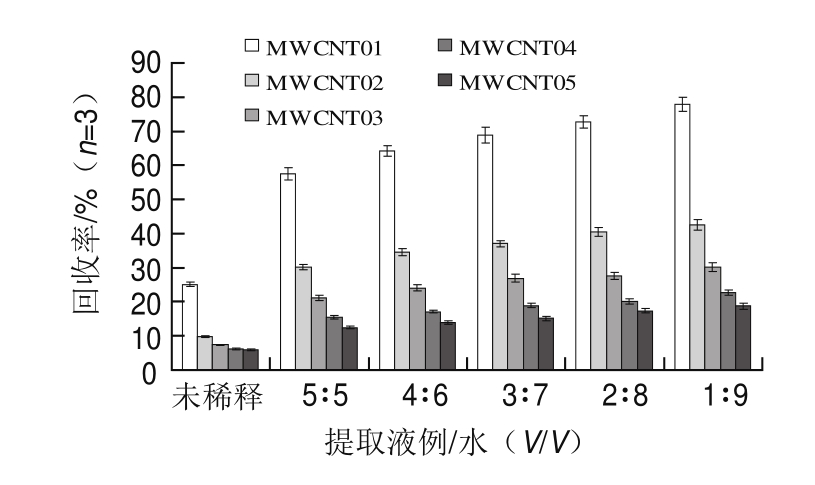
图2 不同比表面积MWCNT对提取液经不同比例超纯水稀释后溶液中金刚烷胺的吸附影响
Fig.2 Effects of MWCNTs with different specific surface areas on the adsorption rates of amantadine in ultrapure water diluted samples of chicken muscle extract
如图3所示,随着溶液pH值从4变化到11,吸附回收率缓慢上升,但当溶液pH值超过11后,吸附回收率急剧下降。同时经实验表明MWCNT用量对吸附回收率实验表明,随着MWCNT用量从25 mg增加到75 mg,MWCNT对金刚烷胺吸附回收率明显增加,MWCNT用量超过75 mg后,MWCNT对金刚烷胺的吸附回收率没有明显增加,因此实验选择调节稀释液pH值至11和75 mg MWCNT对金刚烷胺进行MWCNT吸附实验。
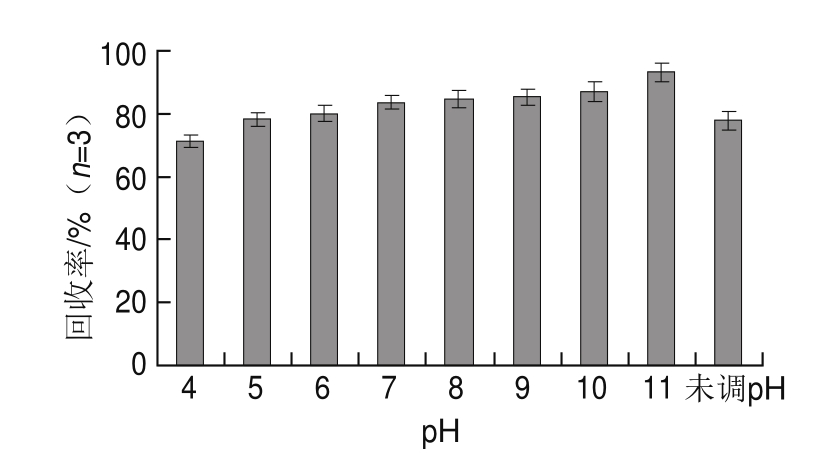
图3 不同pH值条件下对金刚烷胺吸附回收率的影响
Fig.3 Effects of different pH levels on the recovery of amantadine
2.3.3 洗脱液的选择和优化
如图4可知,当洗脱液中甲酸溶液和甲醇比例为5∶5时,金刚烷胺在各甲酸体积分数点的回收率均高于相应甲酸溶液和甲醇比例为时的7∶3回收率;同时当甲酸溶液中甲酸体积分数在5.0%以上并且甲酸溶液和甲醇比例为5∶5时,金刚烷胺的回收率随甲酸体积分数的增加没有较明显的增加,因此本实验最终选择洗脱液中甲酸溶液和甲醇的比例为5∶5,甲酸体积分数为5.0%。
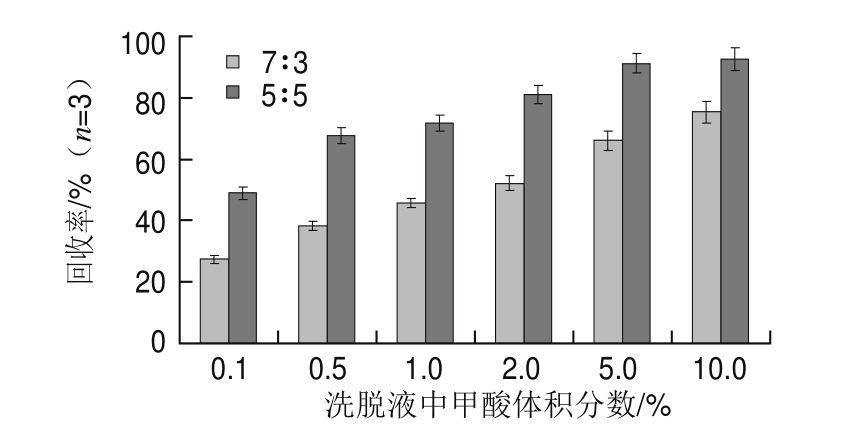
图4 洗脱液中甲酸体积分数对金刚烷胺洗脱回收率的影响
Fig.4 Effects of elution with different concentrations of formic acid on the recovery of amantadine
2.4 方法参数
2.4.1 标准曲线与线性范围
对金刚烷胺按照1.3.1节的步骤制备质量浓度在0.05~5.0 μg/L的标准工作液进行LC-MS-MS分析后以定量离子对和内标离子对峰面积的比值对质量浓度作图,所得曲线方程为y=0.464 9x+0.042 2,相关系数r=0.999 5,说明本方法适用于鸡肉中金刚烷胺的定量分析。
2.4.2 灵敏度
根据测定标准曲线所得的结果,配制相近浓度的阳性添加样品,测定其实际信噪比。以R
SN=3为检测限,以R
SN=10为定量限。结果表明,鸡肉样品中金刚烷胺的检出限为0.15 μg/kg,定量限为0.50 μg/kg。
2.4.3 准确度和精密度
取空白鸡肉样品,加入标准工作溶液配制成0.50、0.75、1.0 μg/kg的加标样品,按照1.3.2节进行操作,每个添加超纯水平重复3次,每次每个浓度3个加标样品进行定量分析。结果表明批内和批间的变异系数均小于10%,回收率均在97.8%~103.6%之间(表2),空白样品和添加图谱详见图1。
表2 鸡肉中金刚烷胺的平均回收率和变异系数(n=3)
Table 2 Mean recoveries (MR) and variation coefficients (cv) of amantadine in chicken muscle (n= 3)
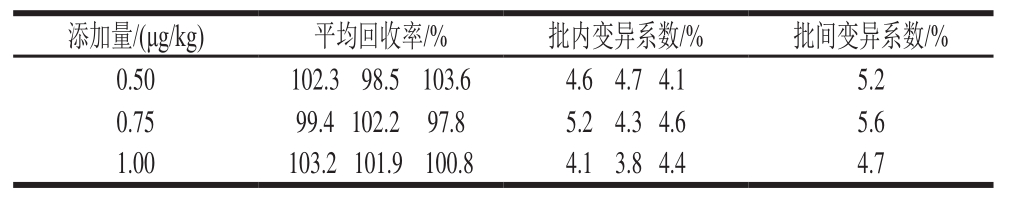
添加量/(μg/kg)平均回收率/%批内变异系数/%批间变异系数/% 0.50102.3 98.5 103.64.6 4.7 4.15.2 0.7599.4 102.2 97.8 5.2 4.3 4.65.6 1.00103.2 101.9 100.84.1 3.8 4.44.7
2.5 方法应用
利用该方法在2013年底对宁波市江区大型超市所售24 个鸡肉样品进行了金刚烷胺残留量测定,所有样品均未检出金刚烷胺。
3 结 论
建立了鸡肉中金刚烷胺的快速测定LC-MS-MS方法。鸡肉样品经酸化乙腈提取后,提取液经稀释后直接进行以MWCNT为吸附材料的分散固相萃取净化,洗脱液无需进行其他操作可直接进行LC-MS-MS法测定。该方法具有快速、灵敏、准确的特点,可适用于我国对金刚烷胺在动物生产中非法使用的监控要求。
参考文献:
[1] U.S. FDA. FDA prohibits use of antiviral drugs in poultry to help keep drugs effective for humans[EB/OL]. [2014-01-15]. http://www.fda. gov/News Events/Newsroom/Press Announcements/2006/ucm108620. html.
[2] 中华人民共和国农业部. 农业部560号公告 兽药地方标准废止目录[EB/OL]. [2014-01-15]. http://www.moa.gov.cn/zwllm/tzgg/ gg/200511/t20051117_496523.html.
[3] 韩加怡, 傅红云. 毛细管气相色谱法测定复方盐酸金刚乙胺胶囊中的盐酸金刚乙胺[J]. 色谱, 2005, 23(6): 683.
[4] 修虹, 黄榕珍, 付梅春. HPLC-ELSD法测定复方氨酚烷胺胶囊中盐酸金刚烷胺及对乙酰氨基酚的含量[J]. 中国药品标准, 2006, 7(1): 23-25.
[5] HIGASHI Y, UEMORI I, FUJII Y. Simultaneous determination of amantadine and rimantadine by HPLC in rat plasma with precolumn derivatization and fluorescence detection for pharmacokinetic studies[J]. Biomedical Chromatography, 2005, 19(9): 655-662.
[6] HIGASHI Y, FUJII Y. Simultaneous determination of the binding of amantadine and its analogues to synethetic melanine by liquid chromatography after precolumn derivatization with dansylchloride[J]. Journal of Chromatography Science, 2005, 43(4): 213-217.
[7] CUI SJ, FENG F, LIU H, et al. New method for high-performance liquid chromatographic determination of amantadine and its analogues in rat plasma[J]. Journal of pharmaceutical and biomedical analysis, 2007, 44(5): 1100-1105.
[8] REVILLA AL, HAMACEK J, LUBAL P. Determination of rimantadine in pharmaceutical preparations by capillary zone electrophoresis with indirect detection or after derivatization[J]. Chromatographia, 1998, 47(7/8): 433-439.
[9] ARNDT T, GUESSREGEN B, HOHL A, et al. Determination of serum amantadine by liquid chromatography-tandem mass spectrometry[J]. Clinica Chimica Acta, 2005, 359(1/2): 125-131.
[10] WANG P, LIANG YZ, CHEN BM, et al. Quantitative determination of amantadine in human plasma by liquid chromatography-mass spectrometry and the application in a bioequivalence study[J]. Journal of pharmaceutical and biomedical analysis, 2007, 43(4): 1519-1525.
[11] CHAN D, TARBIN J, SHAMAN M, et al. Screening method for the analysis of antiviral drugs in poultry tissues using zwitterionic hydrophilic interaction liquid chromatography/tandem mass spectrometry[J]. Analytica Chimica Acta, 2011, 700(1/2): 194-200.
[12] 云环, 张朝晖, 罗生亮, 等. 固相萃取/LC-MS/MS法检测动物源性食品中的金刚烷胺[J]. 现代仪器, 2009, 15(6): 42-45.
[13] 陈慧华, 韦敏珏, 周炜, 等. 液相色谱-串联质谱法测定动物组织中金刚烷胺和金刚乙胺的残留量[J]. 质谱学报, 2013, 34(4): 226-232.
[14] 艾连峰, 马育松, 陈瑞春, 等. 在线净化液相色谱串联质谱法测定动物源食品中金刚烷胺的残留[J]. 分析化学, 2013, 41(4): 1194-1198.
[15] 刘正才, 杨方, 余孔捷, 等. 液相色谱-电喷雾串联质谱法同时检测鸡组织中5种抗病毒类药物的残留量[J]. 色谱, 2012, 30(12): 1253-1259.
[16] 邵琳智, 姚仰勋, 谢敏玲, 等. 亲水相互作用色谱-串联质谱法同时测定动物组织中金刚烷胺与利巴韦林[J]. 分析测试学报, 2013, 32(12): 1448-1452.
[17] 魏秀丽, 高迎春, 陈玲, 等. 超高效液相-串联质谱法测定鸡肉组织中金刚烷胺残留[J]. 中国兽药杂志, 2013, 47(6): 53-55.
[18] BERENDSEN B J A, WEGH R S, ESSERS M L, et al. Quantitative trace analysis of a broad range of antiviral drugs in poultry muscle using columnswitch liquid chromatography coupled to tandem mass spectrometry[J]. Analytica and Bioanalytical Chemistry, 2012, 402: 1611-1623.
[19] YAN H, LIU X, CUI F, et al. Determination of amantadine and rimantadine in chicken muscle by QuEChERS pretreatment method and UHPLC coupled with LTQ Orbitrap mass spectrometry[J]. Journal of Chromatography B, 2013, 938: 8-13.
[20] 曲斌, 朱志谦, 陆桂萍, 等. UPLC-MS/MS快速测定鸡肉中金刚烷胺和氟喹诺酮类药物残留[J]. 中国兽药杂志, 2013, 47(7): 50-54.
Determination of Amantadine in Chicken Muscle by Liquid Chromatography with Tandem Mass Spectrometry Coupled with Dispersive Solid Phase Extraction Using Multiwalled Carbon Nanotubes as Adsorbent
SUN Ya-mi
1, LIU Yong-jun
2, ZHAO Jian
1, YE Yu-fei
1, LÜ Yan
1, WU Yin-liang
1,*
(1. Ningbo Academy of Agricultural Sciences, Ningbo 315040, China;
2. The Center for Animal Disease Control and Prevention, P.R. China, Beijing 100125, China)
Abstract:A simple, sensitive and reliable analytical method was developed for amantadine in chicken muscle by ultra high performance liquid chromatography-positive electrospray ionisation tandem mass spectrometry (UHPLC-ESI-MS/MS) using dispersive solid phase extraction (dSPE) with multi-walled carbon nanotubes (MWCNTs). Chicken muscle was extracted using 1.0% acetic acid in acetonitrile. After adjusting pH value to 11, 75 mg of MWCNTs were added to absorpt amantadine and 5.0% formic acid solution:methanol (5:5, V/V) was used to elute the compound from the MWCNTs. The eluate was directly analyzed by LC-MS-MS on an Acquity UPLC BEH C
18column with a mixture of methanol and 0.1% formic acid solution as the mobile phase. The samples were quantified with the internal standard calibration curve method. Good linearities were obtained for amantadine in the concentration range of 0.05–5.0 μg/L with correlation coefficient more than 0.999. The recoveries for amantadine in chicken muscle were 97.8%–103.6% at three fortified levels (0.5, 0.75 and 1.0 μg/kg) with relative standard deviations less than 10.0% (n = 3). The limit of quantitation was 0.5 μg/kg.
Key words:amantadine; LC-MS-MS; MWCNTs; dispersive solid phase extraction
中图分类号:TS251.7
文献标志码:A
文章编号:1001-8123(2014)04-0014-05
收稿日期:2014-01-23
作者简介:孙亚米(1963ü),女,农艺师,学士,研究方向为农产品中农兽药残留分析。 E-mail:zhangsky001@tom.com
*通信作者:吴银良(1975ü),男,教授级高级工程师,博士,研究方向为农产品中农兽药残留分析。
E-mail:wupaddyfield@sina.com