廉双秋 1,崔大付 2,邓绍立 1
(1.北京中龙益诚科技有限公司,北京 100071;2.中国科学院电子学研究所传感技术国家重点实验室,北京 100190)
摘 要:利用表面等离子体共振技术检测猪尿液中的盐酸克伦特罗。将盐酸克伦特罗-牛血清白蛋白偶联物作为传感芯片特异识别探针结合到生物芯片表面,通过溶液竞争法结合表面等离子体共振技术检测盐酸克伦特罗。标准曲线被建立并且检测盐酸克伦特罗的检测限能够达到1.03 ng/mL,与莱克多巴胺、沙丁胺醇无交叉反应,具有良好的特异性,猪尿的回收率为98.2%~107.0%,变异系数在可接受范围内。所采用的表面等离子体共振方法对于检测猪尿中的盐酸克伦特罗具有灵敏性,准确性,精密性。
关键词:表面等离子体共振;盐酸克伦特罗;免疫反应;快速检测
盐酸克伦特罗是一种β-肾上腺受体激动剂,通常用作呼吸道疾病及哮喘的药物治疗,使用剂量5~10 倍时具有减少动物脂肪、增加瘦肉率、促进动物生长的功能,也是养殖中非法添加较多的“瘦肉精”种类之一,食用含有盐酸克伦特罗的肉及肉制品易在人体组织累积,可能导致腹痛、腹泻、心律失常等许多严重的健康问题 [1],此外因其对人体的负面影响,国家严格禁止β-肾上腺受体激动剂在畜牧业中使用 [2],盐酸克伦特罗与其他β-肾上腺受体激动剂相比毒性较高,易在人体积累,因此必须对动物养殖过程中的盐酸克伦特罗的非法使用进行监控和检测。
传统检测盐酸克伦特罗主要分为色谱法。免疫法两大类,色谱法主要分高效液相色谱法 [3]、液相色谱-串联质谱法 [4-6]、气相色谱-质谱法 [7-8],尽管这些色谱方法可以提供较好的令人满意的重现性结果,但仪器价格昂贵、前处理复杂,检测耗时,无法实现高通量检测,成本高,且不适合现场检测 [9],通常用于确证分析;免疫法检测,主要有免疫传感器 [10-12]、酶联免疫法 [13]、胶体金试纸卡 [14],酶联免疫试剂盒检测时间较长,且需二抗标记,污染环境,且底物和硫酸对操作人员有害,实验结果重现性差,胶体金试纸卡,检测时间短,3~5 min检测一个样品,但其易出现假阴性、假阳性结果,准确率较低 [9];因此建立快速、准确、灵敏、安全的盐酸克伦特罗检测方法具有重要意义。
表面等离子体共振(surface plasmon resonance,SPR)技术广泛应用于医疗诊断、药物筛选、食品安全、环境检测等领域 [15-19]。具有实时监测动态反映过程、灵敏度高、样品无需标记、样品用量少、样品制备时间少、便携等优点 [20],本研究采用表面等离子体共振技术,利用盐酸克伦特罗抗原抗体相互作用原理检测了实际样品中的盐酸克伦特罗,以期为食品安全监督管理中如何利用表面等离子体共振技术进行检测β-肾上腺受体激动剂提供一定的参考依据。
1.1 材料与试剂
猪尿 中国农业科学院农业质量标准与检测技术研究所。
盐酸克伦特罗(clenbuterol hydrochlorid,CLB,相对分子质量为313.7)、莱克多巴胺(ractopamine,LAC,相对分子质量337.83)、沙丁胺醇(salbutamol,SAL相对分子质量239.31)标准品均采购自北京盛世康普化工技术研究院;小鼠抗克伦特罗单克隆抗体、盐酸克伦特罗-牛血清白蛋白偶联物(clenbuterol hydrochloridbovine serum albumin conjugate,CLB-BSA)均采购自深圳宝安康生物有限公司;牛血清白蛋白(bovine serum albumin,BSA)以及其他试剂采购自北京鼎国昌盛生物科技技术公司。所有溶液及试剂均需0.22 μm水相微孔滤膜过滤。
1.2 仪器与设备
YC-SPR-A1生物分子互作仪 北京中龙益诚科技有限公司;FYL-YS-50L恒温箱 北京福意电器有限公司;Sigma-3k 15离心机 德国西格玛奥德里奇离心机有限公司。
1.3 方法
1.3.1 CLB芯片制备
实验使用的生物芯片为自行制备,生物芯片修饰采用化学方法修饰 [21],生物芯片修饰完成后,使用体积40 μL 2.0 mg/mL CLB-BSA滴加在生物芯片表面,37 ℃孵育1 h,去离子水冲洗,氮气吹干,在该芯片表面滴加1 mL 30 g/L的BSA,37 ℃孵育30 min,去离子水冲洗,氮气吹干,待测,装入生物分子互作仪器中,使用pH 7.4 PBS(10mmol/L NaH 2PO 4、10 mmol/L Na 2HPO 4、150 mmol/L NaCl、2.37 mmol/L KCl)作为仪器运行缓冲液,即可进行CLB检测。
1.3.2 固定的抗原质量浓度及工作抗体质量浓度的选择
利用仪器运行缓冲液配制体积为40 μL不同质量浓度的CLB-BSA溶液(0.5、1.0、1.5、2.0、2.5 mg/mL),37 ℃孵育1 h,确定最佳CLB-BSA固定质量浓度。
在最佳质量浓度固定条件下,将不同质量浓度的小鼠抗CLB单克隆抗体(10、20、30、4050 μg/mL),分别进样200 μL,进样流速20 μL/min,通过实时监测SPR响应变化,确定抗体最佳使用质量浓度。
1.3.3 芯片表面再生条件选择
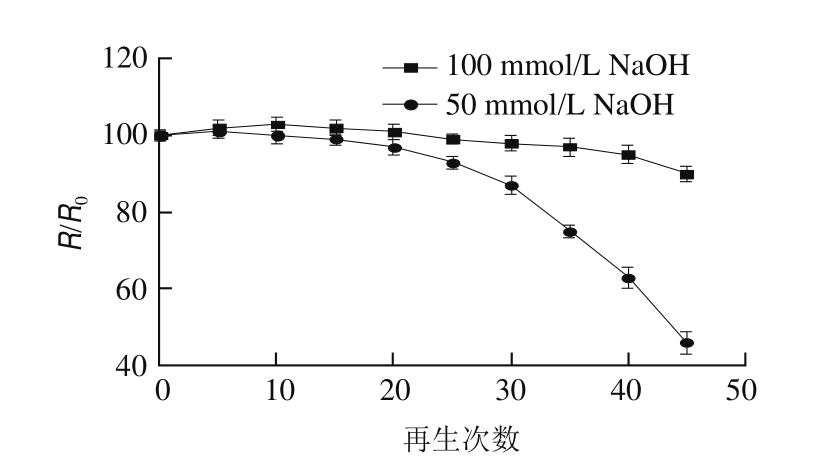
在相同实验条件下,分别使用10 mmol/L Gly-HCl(pH 2.0~2.5)、50 mmol/L NaOH、100 mmol/L NaOH作为再生液,50 mmol/L NaOH作为再生液参数:体积100 μL、流速100 μL/min;100 mmol/L NaOH作为再生液参数:体积70 μL、流速400 μL/min。效果评价以洗脱是否干净,及芯片使用次数为评价标准。
1.3.4 标准曲线的建立
配制不同质量浓度的CLB与等质量浓度抗体等体积(1∶1,V/V)混合,混合溶液中CLB最终质量浓度为(0、0.32、0.63、1.25、2.5、5、10 ng/mL);进样体积200 μL,进样流速20 μL/min,每个质量浓度3 个重复,取平均相对响应值。
1.3.5 特异性检测
选择与盐酸克伦特罗结构和功能类似物,将CLB、LAC、SAL分别稀释至5 ng/mL,设置空白对照,进而确定本研究制备的CLB芯片特异性。
1.3.6 准确性及精密度的检测
取空白猪尿在室温、5 000h g条件下离心10 min,取上清液,进行1、2、5 μg/kg 3 个添加量的加标回收实验,每个样品3 次重复,进样测得响应值,通过标准曲线计算实际测得量,计算回收率及变异系数。
2.1 SPR检测CLB条件优化
2.1.1 抗原固定质量浓度及工作抗体质量浓度的优化
CLB生物芯片测次数与芯片表面固定抗原的活性有关,芯片表面固定的抗原活性会随着再生次数的增加而活性降低,因此一般进行质量浓度检测时要求芯片高固定量,但CLB-BSA固定的量并非越多越好,芯片表面固定CLB-BSA过量会产生空间位阻,进而阻碍CLB抗体对CLB-BSA的特异性结合位点识别,本实验采用不同质量浓度的CLB-BSA进行抗原固定,随着CLB-BSA质量浓度的增加,SPR相对响应值增大,质量浓度为2.0 mg/mL时接近饱和,因此选择2.0 mg/mL作为抗原固定质量浓度。
溶液竞争法的抗体筛选遵循原则为:使待测液中的CLB与芯片表面固定的CLB-BSA能够有效的与溶液中的CLB单克隆抗体反应,此方法要保证CLB-BSA质量浓度≥小鼠抗CLB单克隆抗体质量浓度>CLB质量浓度,将不同质量浓度的CLB抗体,进样相同体积,相同流速,在一定范围内抗体质量浓度越高,SPR相对响应值越大,且抗体质量浓度影响实验检测的检出限、线性检测范围、单个样品检测的时间以及实验成本,本研究综合以上要素筛选抗体最佳质量浓度为30 μg/mL。
2.1.2 不同再生条件对芯片检测次数的影响
生物传感芯片表面再生条件对实验结果的准确性、样品的重复性以及芯片的使用寿命影响较大,针对本实验的反应类型再生的目的就是破坏CLB-BSA与小鼠抗盐酸克伦特罗单克隆抗体的非共价键结合,抗体的洗脱必须完全,并保证固定在芯片表面的CLB-BSA的活性,本实验首先选用条件温和的Gly-HCl缓冲液,pH 2.0~2.5作为再生试剂,结果表明,CLB-BSA与小鼠抗CLB单克隆抗体不能彻底分离,达不到再生的目的,使用50、100 mmol/L NaOH作为再生液,通过检测芯片可再生次数与SPR响应变化比较2 种再生液的再生效果,其中R 0为CLB芯片第1次检测的相对响应值,R表示经过多次再生的SPR相对相应值,横坐标为再生次数。由图1可知,2 种再生液再生25 次左右时生物活性相差较小,再生25 次后50 mmol/L NaOH CLB芯片生物活性下降较快,而再生45 次芯片活性低于50%,用100 mmol/L NaOH再生45 次时芯片仍有较好活性。采用100 mmol/L NaOH、体积70 μL、流速400 μL/min表明芯片表面再生效果最好。

2.2 CLB检测
2.2.1 标准曲线绘制
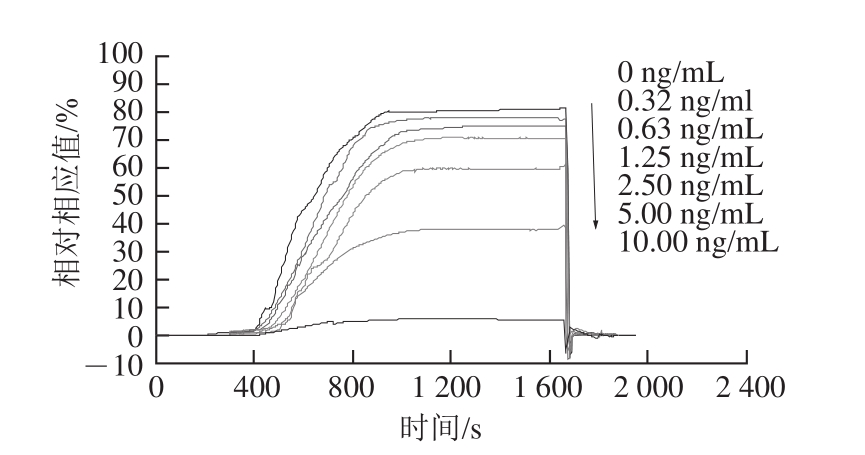
图2 不同质量浓度CLB的相对响应图
Fig.2 SPR relative response of CLB at different concentrations
表面等离子体共振检测研究中标准曲线的构建一般使用仪器运行缓冲液配制,常用PBS缓冲液及HBS缓冲液配制标准曲线来消除溶剂效应(物质本体折光率变化导致溶剂效应),猪尿的主要成分含钾、镁、磷、钙、钠等元素的无机盐类,以及尿酸、尿素、马尿酸等物质,因样品基质中含盐较高,也即本体折光率较大,为消除其基质影响,本实验采用空白猪尿配制CLB标准溶液,不同质量浓度的CLB的SPR响应变化如图2所示,使用Origin软件非线性拟合,得方程y=0.23x 2-10.03x+81.89,拟合曲线的相关系数R 2为0.999,最低检出限为空白样品的相对响应值(83.13%)减去3 倍的标准差(11.15%)对应样品的质量浓度,最低检测值为1.03 ng/mL,通过拟合方程可以得出IC 50为4.84 ng/mL,线性检测范围为1.68~8.09 ng/mL。
2.2.2 特异性检测
免疫分析中的特异性是影响定量检测能力的重要因素,在实际样品检测过程中,待测物一般是与其他多种化合物混合存在而非单独存在,如果抗体的交叉反应多,则不能对某一种物质进行精确的定量检测 [22],对仪器运行缓冲液PBS(空白对照)、CLB、LAC、SAL进行SPR盐酸克伦特罗生物传感芯片特异性检测,结果如图3所示,检测相同质量浓度的样品,仅通入CLB溶液相对PBS的缓冲液折光率发生变化,其他2种瘦肉精对比PBS缓冲液均无明显变化,此方法检测CLB具有较好的特异性。
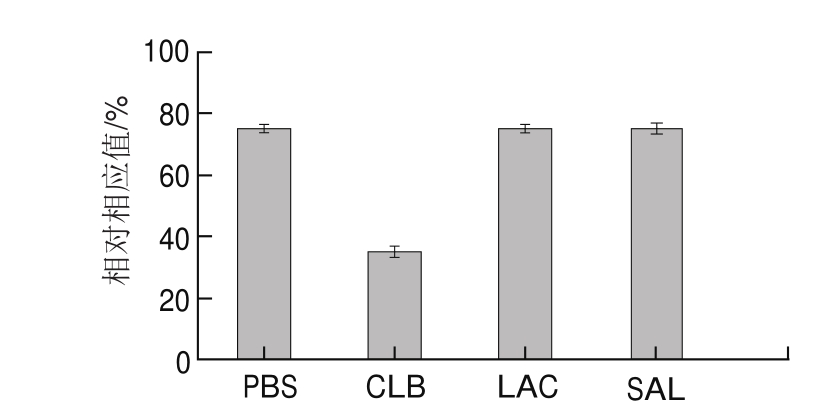
图3 SPR免疫传感器对CLB的特异性检测
Fig.3 The specificity of SPR immune-sensor for detection of CLB
2.2.3 准确性及精密度检测
准确性是指样品实际测定值与真实值的符合程度,一般用加标回收率实验表示,精密度是指一个样品多次测定结果的变化程度,通常用批内变异系数与批间变异系数表示 [23]。由表1可知,SPR方法检测CLB回收率范围在98.2%~107.0%,批内变异系数小于4%,批间变异系数小于9%,重现性好,SPR方法的准确性和精密度良好,此方法可用于动物性食品中盐酸克伦特罗检测。
表1 SPR准确性和精密性实验结果
Table 1 Accuracy and precision of the SPR assay
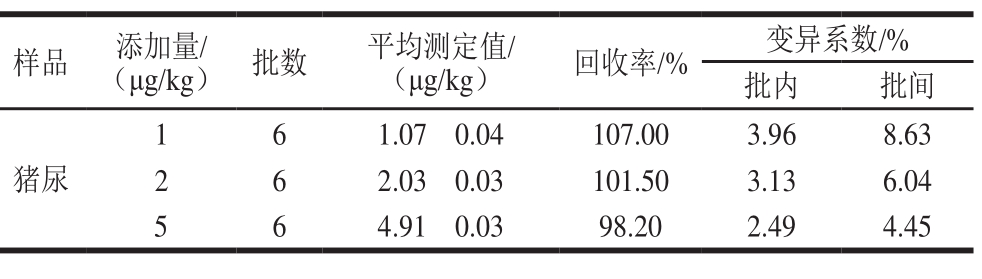
样品添加量/(μg/kg)批数平均测定值/(μg/kg)回收率/%变异系数/%批内批间猪尿161.07f 0.04107.003.968.63 262.03f 0.03101.503.136.04 564.91f 0.0398.202.494.45
针对CLB建立SPR检测方法,对不同质量浓度CLB的猪尿液进行实验研究,实现了CLB的定量检测,对CLB进行灵敏度检测,检出限为1.03 ng/mL,选择LAC、SAL进行SPR方法特异性分析,实验结果表明SPR方法检测CLB具有较好的特异性,并进行SPR方法准确性及精密度检测,此方法检测CLB可在实际检测中应用。CLB是β-受体激动剂的一种,该方法对其进行成功检测,可以将此方法推广使用至其他β-受体激动剂检测。
参考文献:
[1] BRAMBILLA G, CENCI T, FRANCONI F, et al. Clinical and pharmacological profile in a clenbuterol epidemic poisoning of contaminated beef meat in Italy[J]. Toxicology Letters, 2000, 114(1): 47-53.
[2] LIU Ming, NING Baoan, QU Lijie, et al. Development of indirect competitive immunoassay for highly sensitive determination of ractopamine in pork liver samples based on surface plasmon resonance sensor[J]. Sensors and Actuators B: Chemical, 2012, 161(1): 124-130.
[3] 张群, 刘烨. 固相萃取-反相高效液相色谱法测定鲜肉中盐酸克伦特罗残留量的条件优化[J]. 现代食品科技, 2009, 25(3): 337-340.
[4] 蒋万枫, 赵珊. 超高液相色谱-四级杆-飞行时间质谱法快速筛查动物组织中7种β-受体激动剂残留[J]. 分析测试学报, 2013, 32(6): 675-680.
[5] 甘盛, 施晓光. 液相色谱-串联质谱法测定羊肉中的瘦肉精[J]. 现代食品科技, 2011, 27(9): 1146-1149.
[6] 赵颖, 刘瑜, 金雁, 等. 超高效液相色谱-电喷雾串联四极杆质谱法同时测定中29 种兽药[J]. 色谱, 2012, 30(9): 908-914.
[7] 江勇, 胡贵祥, 朱惠芳. 固相微萃取与气相色谱-质谱联用测定肉产品中的克伦特罗[J]. 肉类研究, 2014, 28(4): 11-13.
[8] 贾涛, 王友月, 肖勇, 等. 气相色谱串联质谱法检测饲料中的盐酸克伦特罗[J]. 饲料研究, 2011(9): 45-48.
[9] 汤轶伟, 王硕, 励建荣, 等. β-兴奋剂盐酸克伦特罗残留检测方法最新研究进展[J]. 中国食品学报, 2013, 13(5): 154-160.
[10] SONG Chunmei, ZHI Aimin, LIU Qingtang, et al. Rapid and sensitive detection of β-agonists using a portable fluorescence biosensor based on fluorescent nanosilica and a lateral flow test strip[J]. Biosensors and Bioelectronics, 2013, 50: 62-65.
[11] HE Pingli, WANG Zongyi, ZHANG Liying, et al. Development of a label-free electrochemical immunosensor based on carbon nanotube for rapid determination of clenbuterol[J]. Food Chemistry, 2009, 112(3): 707-714.
[12] LIU Gang, CHEN Haode, PENG Hongzhen, et al. A carbon nanotubebased high-sensitivity electrochemical immunosensor for rapid and portable detection of clenbuterol[J]. Biosensors and Bioelectronics, 2011, 28(1): 308-313.
[13] WANG Jianping, SHEN Jianzhong. Immunoaffinity chromatography for purification of salbutamol and clenbuterol followed screening and confirmation by ELISA and GC-MS[J]. Food and Agricultural Immunology, 2007, 18(2): 107-115.
[14] ZHANG Mingzhou, WANG Minzi, CHEN Zonglun, et al. Development of a colloidal gold-based lateral-flow immunoassay for the rapid simultaneous detection of clenbuterol and ractopamine in swine urine[J]. Analytical and Bioanalytical Chemistry, 2009, 359(8): 2591-2599.
[15] 王春宇, 冯锋, 白云峰, 等. 基于表面等离子体共振技术用鸡蛋黄抗体IgY测定人血清中转铁蛋白[J]. 高等学校化学学报, 2012, 33(6): 1177-1181.
[16] SUHERMAN, MORITA K, KAWAGUCHI T. Highly selective and sensitive detection of β-agonists using a surfaceplasmon resonance sensor based on an alkanethiol monolayerfunctionalized on a Au surface[J]. Biosensors and Bioelectronics, 2014, Aug 27, doi: 10.1016/ j.bios.2014.08.055.
[17] 李辉, 蔡浩源, 陈兴, 等. 表面等离子体共振生物传感器连续检测莱克多巴胺[J]. 分析化学研究简报, 2010, 38(3): 381-384.
[18] SHANKARAND R, GOBIK V, MIURAN. Recent advancements in surface plasmon resonance immunosensors for detection of small molecules of biomedical, food and environmental interest[J]. Sensors and Actuators B: Chemical, 2007, 121(1): 158-177.
[19] FARRÉ M, MARTÍNE Z E, RAMÓN J. Alicia Navarro, part per trillion determination of atrazine in natural water samples by a surface plasmon resonance immunosensor[J]. Analytical and Bioanalytical Chemistry, 2007, 388(1): 207-214 .
[20] JIRˇÍ H. Surface plasmon resonance sensors for detection of chemical and biological species[J]. Chemical Reviews, 2008, 108(2): 462-493.
[21] 高博, 孙秀兰, 张银志, 等. 乳品中金黄色葡萄球菌肠毒素B免疫传感检测方法的研究[J]. 分析科学学报, 2012, 28(2): 25-28.
[22] 杨小娇. 胶体金免疫层析快速检测氯霉素技术研究[D]. 杨凌: 西北农林科技大学, 2007.
[23] 宋爱京, 李秀华, 李娟, 等. HIV抗体酶联免疫诊断试剂批内和批间精确性分析[J]. 中国生物制品学杂志, 2005, 18(2): 157-158.
Detection of Clenbuterol Hydrochlorid in Swine Urine Using Surface Plasmon Resonance
LIAN Shuangqiu 1, CUI Dafu 2, DENG Shaoli 1
(1. Beijing ZhonglongYicheng Technology Co. Ltd., Beijing 100071, China; 2. State Key laboratory of Transducer Technology, Institute of Electronics, Chinese Academy of Sciences, Beijing 100190, China)
Abstract:Surface plasmon resonance technique was used to detect clenbuterol hydrochlorid (CLB) in swine urine. clenbuterol hydrochlorid-bovine serum albumin conjugate (CLB-BSA) as a specific recognition probe was bound to the surface of the biological chip, and the solution competition method combined with surface Plasmon resonance technique was used to detect CLB .The calibration curve was established and the limit of detection was 1.03 ng/mL. No cross reaction with ractopamine or salbutamol was found as well as good specificity. The recoveries of CLB from spiked samples were in the range of 98.2%–107.0%, with acceptable coefficients of variation. The proposed SPR method proved to be sensitive, accurate and precise.
Key words:surface plasmon resonance; clenbuterol hydrochlorid; immunoreaction; rapid detection
中图分类号:TS251.7
文献标志码:A
文章编号:1001-8123(2014)11-0038-04
收稿日期:2014-08-24
作者简介:廉双秋(1984ü),女,硕士,研究方向为食品安全。E-mail:lianshuangqiu0902@163.com