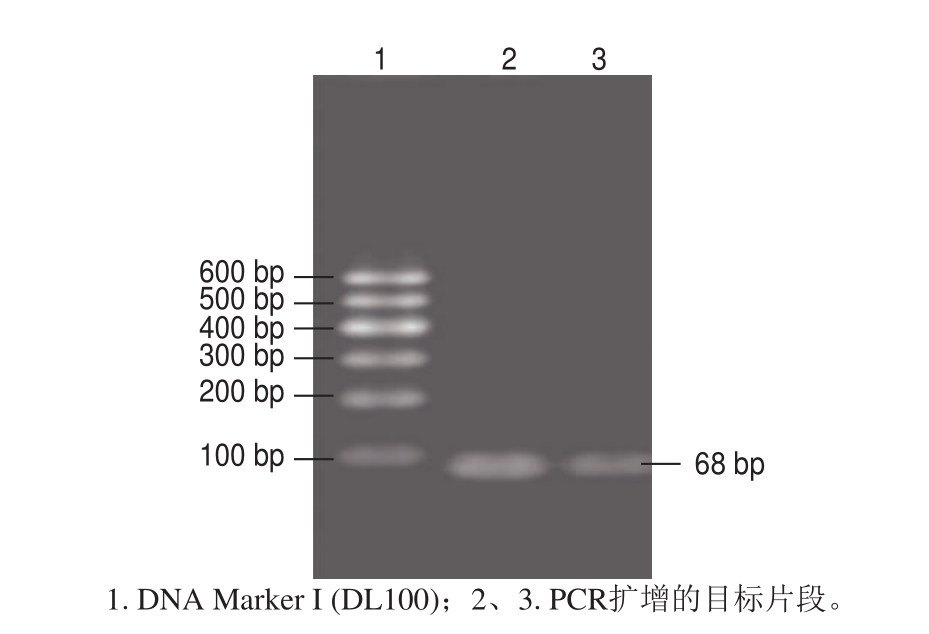
图1 来源于沙门氏菌invA基因的标准阳性模板PCR结果
Fig.1 Electrophoresis of PCR products amplified from the invA gene of Salmonella spp.
陈 晨 1,2,邵 彪 1,*,陈 刚 1,黄伟东 1
(1.南通市产品质量监督检验所,江苏 南通 226011;2.中国药科大学生命科学与技术学院,江苏 南京 211198)
摘 要:目的:构建重组质粒作为标准阳性模板,建立食品中沙门氏致病菌实时荧光定量聚合酶链式反应检测方法。方法:以致病性沙门氏菌invA基因上特异性片段为目标,设计并合成引物和TaqMan 探针,将目标片段连接到PGM-T载体上构建重组质粒,建立实时荧光定量检测体系,并考察方法的灵敏性、特异性、重复性和准确性。结果:构建出致病性沙门氏菌特异性基因片段的重组质粒,能够作为实时荧光定量聚合酶链式反应检测方法的标准阳性模板,标准曲线方程为Y=-3.151 lgX+42.86(R 2=0.999),灵敏度80 拷贝反应体系,能特异区分沙门氏菌与类型的细菌,同时,批内和批间的变异系数均小于5%,具有良好的重复性。结论:本方法能够实现对食品中致病性沙门氏菌进行定性定量检测。
关键词:沙门氏致病菌;标准阳性模板;实时荧光定量聚合酶链式反应;TaqMan 探针
沙门氏菌(Salmonella spp.)是引起细菌性食物中毒的重要病原菌之一,可引发急性肠胃炎、伤寒以及副伤寒 [1]。沙门氏菌广泛存在于肉制品、水产品、蛋、乳类等产品中,菌型较多,已发现的血清型超过2 500多种 [2-4]。
目前,在全球范围内细菌性食物中毒事件中,沙门氏菌引起的中毒常居首位,因此,对食品中沙门氏致病菌检测已是必不可少的项目。然而,传统的细菌培养、理化鉴定的检测方法,过程复杂,操作繁琐,周期较长,不适合目前应急处理,同时,也难以实现大量样品检测的要求。因此,研究沙门氏菌的快速检测方法成为食品微生物检测领域的热点,目前,主要集中在两个技术技术领域,即以聚合酶链式反应(包括普通聚合酶链反应(polymerase chain reaction,PCR)、荧光PCR、逆转录PCR) [5-8]、基因芯片 [9-10]、环介导等温扩增 [11-12]等为代表的分子生物技术和以酶联免疫吸附 [13-14]、免疫荧光标记 [15-16]等为代表的免疫学技术。其中,随着分子生物学检测技术的发展,尤其是实时荧光定量PCR展现出来的优势,使其在食品、疾控等检测领域中扮演越来越重要的角色。
研究发现,沙门氏菌的致病性与其inv基因簇(包括invA、invB、invC、invD及invE等)编码的侵袭蛋白密切相关,该类蛋白决定细菌进入宿主上皮细胞的能力。而其中的invA基因编码的蛋白,是沙门氏菌致病力所必需的毒力因子,该蛋白作用在于吸附和侵袭上皮细胞表面,因此,invA基因决定沙门氏菌对细胞的侵袭力,是沙门氏致病菌区别于其他细菌的标志 [17-20]。所以,invA基因适合致病性沙门氏菌的检测。
本实验以invA基因为目标,设计引物和探针,构建重组质粒标准阳性模板,建立TaqMan探针法检测食品中沙门氏菌的方法。
1.1 菌种、材料与试剂
沙门氏菌、金黄色葡萄球菌、大肠埃希式菌、枯草芽孢杆菌、单增李斯特菌等皆为实验室保藏菌株。
细菌基因组DNA提取试剂盒、离心柱型-质粒小提试剂盒、DNA Marker Ⅰ、PCR 混合反应液 北京天根有限公司;E.Z.N.A. 凝胶回收试剂盒(V-spin) 美国Omega公司;PGM-T 连接试剂盒、JM-109感受态细胞、实时荧光定量PCR预混反应试剂盒 大连TaKaRa公司。
1.2 仪器与设备
Ct荧光定量PCR八连管(平盖) 美国Axygen公司;Mx3000P 实时荧光定量PCR仪 美国Agilent公司;CF15RX 离心机 日本Hitachi公司;微量移液器 美国Thermo公司;电泳仪 美国Bio-Rad公司;MG96G 型梯度型PCR仪 杭州朗基科学仪器有限公司。
1.3 方法
1.3.1 细菌培养
实验所涉及各种细菌增菌培养方法均参照GB/T 4789.1ü 2010《食品微生物学检验 总则》进行。
1.3.2 细菌基因组DNA的提取
采用细菌基因组DNA提取试剂盒,按照说明书步骤进行。
1.3.3 引物与TaqMan探针设计合成
从GenBank中获取各种不同来源的沙门氏菌的invA基因序列,应用Primer Express软件分析基因序列,根据文献提供的TaqMan引物和探针设计原则,在这些序列的保守区域筛选一对引物:上游引物5’-ATAGCCAAGCTCCCGGAGTT-3’, 下游引物5’-TTAATCCAACAATCCATCAGCAA-3’,并在该引物的扩增区域内设计1条荧光探针:5’-CTCCCCCTCTTCATGCGTTACCCAG -3’。探针5’端标记荧光报告基团ROX,3’端标记荧光淬灭基团TAMRA,委托大连宝生物工程有限公司合成。序列测定由生工生物工程(上海)股份有限公司完成。
1.3.4 普通PCR反应体系的选择
2h Taq PCR混合反应液25 μL,上下游引物(10 μmol/L)各2 μL,模板DNA 4 μL,加水至50 μL。反应条件:预变性94 ℃、5 min;变性 94℃、5 s,退火55℃、30s,延伸72℃、30 s,35 个循环;最后72 ℃延伸10 min。
1.3.5 核酸电泳实验
1.8%琼脂糖凝胶,100 V电压下进行电泳45 min,凝胶成像系统观察,拍照。
1.3.6 标准阳性模板的构建 [21]
以沙门氏菌菌株的基因组为模板,利用设计的引物扩增目的基因片段。扩增产物1.8%琼脂糖凝胶电泳,凝胶回收试剂盒回收扩增条带,连接到PGM-T载体上,并导入到JM-109感受态细胞中,37 ℃培养过夜,挑取单个菌落,以上游引物和下游引物进行PCR筛选,挑取阳性菌克隆,再经测序验证。重组质粒采用质粒试剂盒抽提,10 倍稀释后用紫外分光光度计260 nm波长检测吸光度(A),计算其拷贝数。
拷贝数/(拷贝/mL)=50(g/mL)h 10 -6h Ah 6.02h 10 23/660 g×扩增碱基数
1.3.7 反应体系与反应参数
实时荧光定量PCR反应体系为25 μL,包括:实时荧光定量PCR预混反应试剂12.5 μL,上、下游引物(10 μmol/L)各1 μL,荧光探针0.5 μL,模板2 μL,无菌水 8 μL。实时荧光定量PCR仪反应参数设置:95 ℃变性90 s,以95℃、5 s;55℃、30 s;72℃、30 s;扩增40 个循环,荧光信号ROX,在退火温度结束时开始收集信号。
1.3.8 灵敏度分析
将制备的标准模板,按10 倍递增稀释,分别用本研究建立的实时荧光定量PCR检测体系进行检测,考察检测下限,对灵敏性进行评价。
1.3.9 标准曲线的建立
以各标准模板的拷贝数为横坐标,以其对应的Ct值为纵坐标,建立标准曲线。
1.3.10 特异性实验分析
不同种属的细菌经增菌后提取基因组DNA,并以此为模板采用本研究建立的荧光定量PCR体系进行特异性分析。
1.3.11 重复性分析
分别于同一批次内和不同批次间,重复5 次测定同一浓度的模板下的Ct值,分析扩增曲线Ct值变异,考察方法的重复性。
1.3.12 实时荧光定量PCR与传统检测方法比较
分别采用本实验建立的实时荧光定量PCR方法及传统平板计数法检测10 份待检样品和5 份人工随机污染样品,比较检测结果。
2.1 目标片段的扩增
将沙门氏菌标准菌株增菌后,用试剂盒抽提基因组DNA,并以此为模板利用设计好的引物进行常规PCR,1.8%琼脂糖凝胶电泳结果如图1所示。扩增产物条带单一,扩增片段长度约为86 bp,与目标片段长度相符。利用胶回收试剂盒,回收目标片段,-20 ℃ 保存备用。

图1 来源于沙门氏菌invA基因的标准阳性模板PCR结果
Fig.1 Electrophoresis of PCR products amplified from the invA gene of Salmonella spp.
2.2 重组质粒的制备
将PCR扩增的片段连接到PGM-T载体上,并导入到JM-109感受态细胞中,37 ℃培养过夜,挑取单个菌落,以上游、下游引物进行PCR筛选,挑取阳性菌克隆进行序列测试,结果如下:
5’-ATAGCCAAGC TCCCGGAGTT TCTCCCCCTC TTCATGCGTT ACCCAGAAAT ACTGACTGCT ACCTTGCTGA TGGATTGTTG GATTAA -3’。
经验证,序列顺序与数据库中序列顺序一致。
重组质粒采用质粒试剂盒抽提,紫外分光光度计测定其 260 nm波长处吸光度为0.027 2,经计算其拷贝数为4h 10 11拷贝/mL。
2.3 灵敏度分析
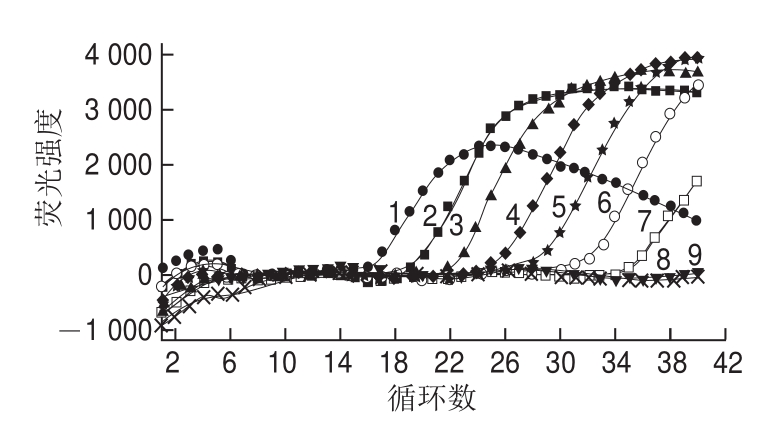
图2 灵敏度分析
Fig.2 Sensitivity of FQ-PCR
将制备好的标准模板按10 倍递减稀释,进行实时荧光定量PCR检测。由图2可知,随着标准模板的递减稀释,Ct值不断增大,至4h 10 4拷贝/mL时仍有荧光信号,根据每个反应体系加入2 μL的模板,因此可以得出该方法的灵敏度为80 拷贝反应体系。
2.4 标准曲线的建立
以不同浓度标准模板的拷贝数为横坐标(X),以其对应的Ct值为纵坐标(Y),建立标准曲线,得线性方程为Y=-3.151 lgX+42.86(R 2=0.999)。
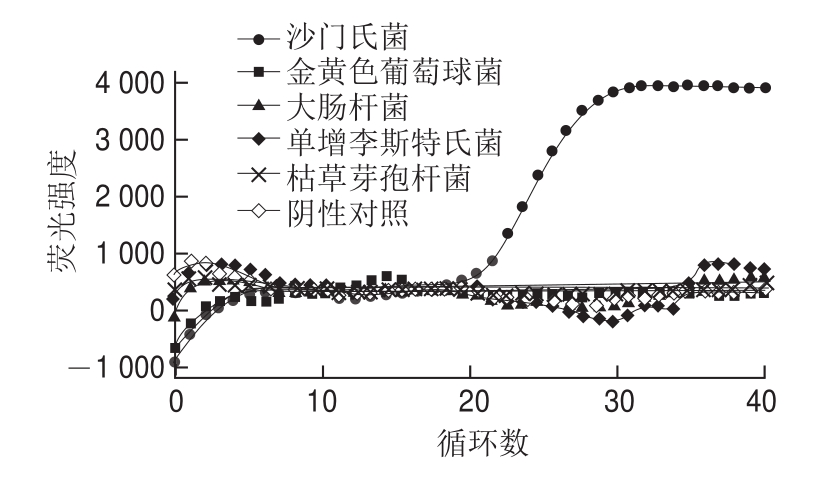
2.5 特异性分析
由图3可知,只有沙门氏菌基因组模板具有典型的荧光扩增曲线,其余各菌与阴性对照类似,无荧光扩增曲线。表明该法检测沙门氏菌具有良好的特异性。
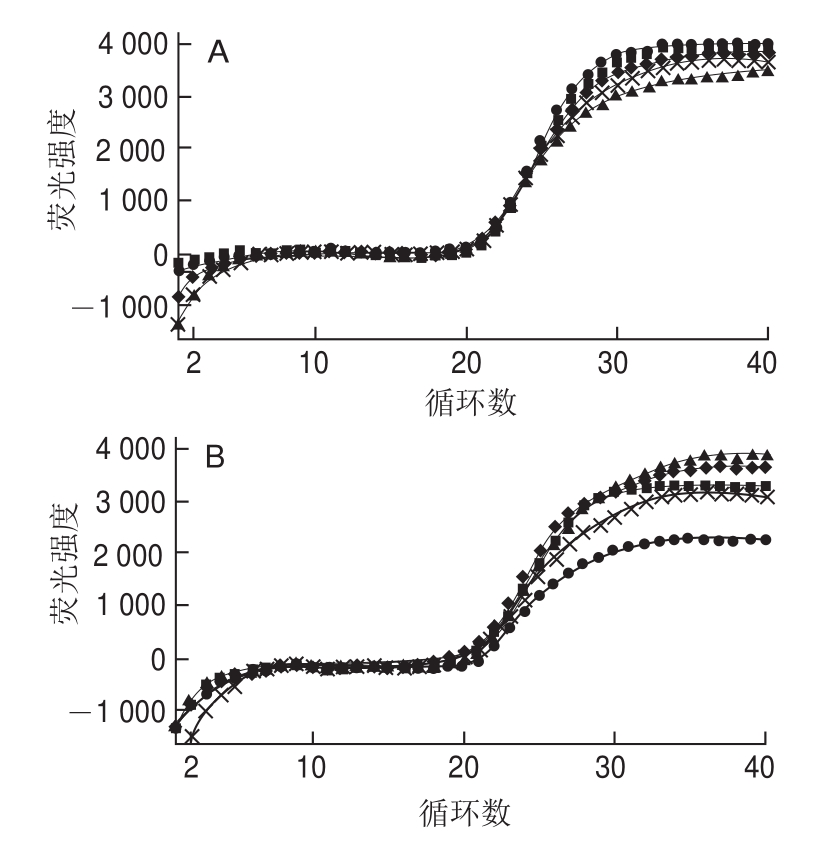
图4 实时荧光定量PCR 重复性分析
Fig.4 Repeatability of FQ-PCR
A.批内重复性分析;B.批间重复性分析。
2.6 重复性分析
采用已建立的方法在同一批次内5 次测定同一模板浓度,结果如图4A所示,所得扩增曲线基本吻合,Ct值分别为22.63、22.68、22.45、22.50、22.54,相对标准偏差为0.5%。同时,批间5 次测定同一模板浓度,结果如图4B所示,Ct值分别为22.68、21.82、22.15、22.33、22.17,标准偏差为2.8%。表明该方法具有很好的可重复性,所得结果有较高精密度。
2.7 实时荧光定量PCR和BS琼脂平板计数法检测结果比较
10 份待检食品样品分两组,分别采用实时荧光定量PCR和BS琼脂平板计数检测,均呈阴性结果。人工随机污染样品测定结果见表1,两种方法作定性检测的结果一致。
表1 实时荧光定量PCR和BS琼脂平板检测人工随机污染样品结果比较
Table 1 Comparison of results obtained for artificially contaminated samples by FQ-PCR and Baird-Parker method
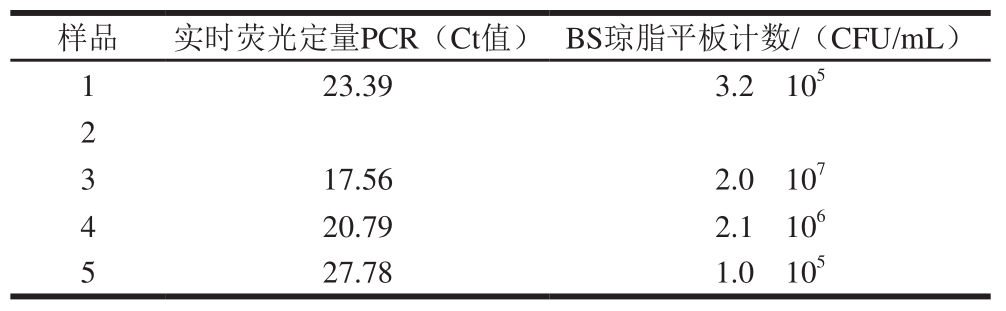
注:ü .无检测数值。
样品实时荧光定量PCR(Ct值)BS琼脂平板计数/(CFU/mL)1 23.393.2h 10 52 ü ü 3 17.562.0h 10 74 20.792.1h 10 65 27.781.0h 10 5
针对沙门氏菌检测,基于分子生物学的方法多有报道,主要检测目标包括fimA、NAa、agfA、stin、IS200、iroB、mkfA、ompC、oriC、spvR以及viaB等基因 [22-25]。目前,也有多个基于invA基因检测沙门氏菌的报道,如运用SYBR Green I染料法荧光定量PCR方法 [26]。本研究根据沙门氏菌invA基因选择特异的引物与TaqMan探针,制备含特异片段的重组质粒作为标准阳性模板,建立了实时荧光定量PCR检测方法。该方法的灵敏度为80 拷贝反应体系,对沙门氏菌有特异性,且稳定性高、重复性好。使用该方法检测样品与所得结果与BS琼脂平板法具有一致性,从而表明,应用实时荧光PCR技术检测食品中沙门氏菌准确可靠。相对于传统检测方法而言,本实验所建立的方法具有检测周期短、操作过程简单、能够实现高通量检测等优点,能够满足当前高效快速的检测要求。
参考文献:
[1] 赵薇, 刘桂华, 张秀丽. 食品中沙门氏菌血清及PFGE分型研究[J].中国卫生工程学, 2012, 11(6): 443-446.
[2] CALLAWAY T R, EDRINGTON T S, ANDERSON R C, et al. Gastrointestinal microbial ecology and the safety of our food supply as related to Salmonella[J]. Journal of Animal Science, 2010, 86: E163-E172.
[3] 刘慧玲, 万志刚, 洪小柳, 等. 进出口食品中不同血清型沙门氏菌PFGE 和MLST分型比较研究[J]. 食品安全质量检测学报, 2014(11): 3454-3461.
[4] 黄文宇, 柳陈坚. 食源性沙门氏菌检测方法的研究进展[J]. 生物技术, 2009, 19(3): 95-98.
[5] 章新生, 臧富妍. 应用PCR技术检测沙门氏菌[J]. 中国兽医学报, 1999, 19(2): 46-50.
[6] 向雪菲, 刘斌, 张利达, 等. 食品中沙门氏菌分子检测靶点的筛选与评价[J]. 微生物学报, 2008, 48(7): 941-946.
[7] 刘仲敏, 郑鸣, 王永芬, 等. 食源性沙门氏菌实时定量PCR检测研究[J].食品工业科技, 2007, 28(8): 233-236.
[8] 周晓清, 李苗云, 刘杰, 等. 一步法逆转录荧光定量PCR检测食源性沙门氏菌[J]. 食品科学, 2013, 34(12): 183-187.
[9] KOSTIC T L. A microbial diagnostic microarray technique for the sensitive detection and identification of pathogenic bacteria in a background of nonpathogens[J]. Analytical Biochemistry, 2007, 360(2): 244-254.
[10] COURTNEY S, MOSSOBA M E, HAMMACK T S, et al. Using PCR amplification to increase the confidence level of Salmonella typhimurium DNA microarray chip hybridization[J]. Molecular and Cellular Probes, 2006, 20(3/4): 163-171.
[11] 田桢干, 阎俊, 陆晔, 等. LAMP技术快速检测沙门氏菌方法的建立及其应用[J]. 中国国境卫生检疫杂志, 2011, 34(5): 296-299.
[12] 黄金海, 孙跃辉, 陈瑞, 等. 食品中沙门氏菌LAMP快速检测方法的建立[J]. 天津大学学报, 2012, 45(5): 468-472.
[13] KUMAR S, BALAKRISHNA K, BATRA H V. Enrichment-ELISA for deteCtion of Salmonella typhi from food and water samples[J]. Biomedical and Environmental Sciences, 2008, 21(2): 137-143.
[14] 伍燕华, 牛瑞江, 赖卫华, 等. 双抗夹心酶联免疫吸附法检测沙门氏菌[J]. 食品工业科技, 2014, 35(10): 62-65.
[15] 孙洋, 王云翔, 柳增善. 吖啶橙免疫荧光菌团培养法对沙门氏菌的快速检测[J]. 吉林畜牧兽医, 1994(6): 14-16.
[16] 焦彦朝,审时商. 食品中沙门氏菌酶联免疫荧光分析(VIDAS(R) Sallmonella [SLM]Assay)筛选方法[J]. 口岸卫生控制, 2001(4): 44-46.
[17] MICHAEL B , PETER J . The use of a PCR generated invA probe for the detection of Salmonella spp. in artificailly and naturally contaminated foods[J]. International Journal of Food Microbiology, 1995, 26: 335-344.
[18] ZHAO S, QAIYUMI S, FRIEDMAN S, et al. CharaCterization of Salmonella enterica serotype Newport isolated from humans and food animals[J]. Journal of Clinical and Microbiology, 2003, 41(12): 5366-5371.
[19] 刘仲敏, 郑鸣, 王永芬, 等. 食源性沙门氏菌实时定量PCR检测研究[J].食品工业科技, 2007, 28(8): 233-236.
[20] 钟伟军, 赵明秋, 张彩虹, 等. 食品中沙门氏菌PCR快速检测方法的建立[J]. 中国人兽共患病学报, 2007, 23(12): 1216-1221.
[21] 邵彪, 黄伟东, 周鸣镝, 等. 多重荧光定量PCR检测食品污染菌[J].中国食品学报, 2012, 12(1): 176-181.
[22] 倪梦丽, 杨冰, 王春德, 等. 贝类中副溶血弧菌和沙门氏菌荧光定量PCR 快速检测方法的建立[J]. 中国动物检疫, 2013, 30(8): 78-82.
[23] 杨柳, 苏明权, 马越云, 等. 荧光定量RTPCR 检测沙门氏菌方法的建立[J]. 中国实验诊断学, 2011, 15(1): 17-20.
[24] 但现龙, 刘斌, 李小玲, 等. 添加有扩增内标的沙门氏菌荧光定量PCR检测体系的建立与评价[J]. 微生物学报, 2011, 51(8): 1119-1127.
[25] 张驰, 杨军, 刘新梅, 等. 食品中3种致病菌的TaqMan 多重荧光定量PCR 检测[J]. 食品研究与开发, 2011, 32(4): 151-156.
[26] 张巧艳, 陈亭亭, 陈笑芸, 等. 基于SYBR Green I 荧光定量PCR建立生乳及乳制品沙门氏菌快速检测技术[J]. 浙江农业学报, 2012, 24(5): 914-921.
Construction of Standard Positive Template and Development of a Real-Time Fluorescence Quantitative Polymerase Chain Reaction (FQ-PCR) Assay for Pathogenic Salmonella spp.
CHEN Chen 1,2, SHAO Biao 1,*, CHEN Gang 1, HUANG Weidong 1
(1. Nantong Products Quality Supervision and Inspection Institute, Nantong 226011, China;
2. School of Life Science and Technology, China Pharmaceutical University, Nanjing 211198, China)
Abstract:Objective: To construct recombinant plasmids for use as standard positive template and establish a real-time fluorescent quantitative polymerase chain reaction (FQ-PCR) assay for determining pathogenic Salmonella spp. in foods. Methods: Primers and Taqman probe were designed and synthesized with the specific fragment of InvA gene as the target sequence. Recombinant plasmids were constructed by inserting the target gene into PGM-T carriers. Real-time fluorescent quantitative PCR method was established and its sensitivity, specificity, repeatability and accuracy were investigated. Results: The recombinant plasmids constructed using the specific sequence of pathogenic Salmonella spp. could be used as a standard positive template for fluorescent quantitative PCR. The standard curve was Y=-3.151 lgX + 42.86 (R 2=0.999), and the sensitivity of the method was 80 copies per reaction. It was specific to detect Salmonella spp. with good repeatability (the inter-batch and intra-batch coefficients of variation were both less than 5%). Conclusion: The FQ-PCR method allows qualitative and quantitative detection of pathogenic Salmonella spp.
Key words:Salmonella spp.; standard positive template; fluorescent quantitative polymerase chain reaction (FQ-PCR); TaqMan probes
中图分类号:Q93
文献标志码:A
文章编号:1001-8123(2014)11-0030-04
收稿日期:2014-08-21
基金项目:2013年度国家星火计划项目(2013GA690155);南通市科技计划项目(HS2012007)
作者简介:陈晨(1992—),男,本科,研究方向为食品药品分析。E-mail:957454081@qq.com
*通信作者:邵彪(1983—),男,高级工程师,博士,研究方向为食品药品分析。E-mail:shaobiao1983@sina.com