ISSR分子标记鉴定陆川猪及其肉制品
何瑜林
1,黄 丽
1,*,封 毅
2,*,王 淼
1,滕建文
1
(1.广西大学轻工与食品工程学院,广西 南宁 530004;2.广西中医药大学基础医学院,广西 南宁 530001)
摘 要:采用ISSR分子标记对陆川猪及其肉制品进行鉴伪识别,利用ISSR技术,对纯种陆川猪、陆川猪杂交品种(二元杂猪和三元杂猪)及广西本地的巴马香猪和环江香猪的DNA指纹图谱进行分析。结果表明:从34 条引物中筛选出3 条带型清晰、重复性好的引物WM12、WM27、WM10,其中引物WM12可用于鉴别陆川猪、二元杂猪和三元杂猪的生鲜样品及腊肉制品,引物WM27可用于鉴别陆川猪和巴马香猪的生鲜样品及腊肉制品,引物WM10用可于鉴别陆川猪和环江香猪的生鲜样品及腊肉制品。ISSR技术可快速准确的鉴定陆川猪、陆川猪杂交品种、巴马香猪、环江香猪及其肉制品。
关键词:陆川猪;分子标记技术;ISSR
陆川猪是中国八大地方优良猪种之一,属于国家级保护品种。因其原产于广西省东南部的陆川县而得名。其畜产品可加工成香肠、无皮五花腊肉、白切猪脚、脆皮乳猪、扣肉等肉制品,受到广大消费者的喜爱。但市场上的陆川猪肉制品真伪难辨,目前针对陆川猪及其杂交品种的肉质研究主要是通过测定猪胴体和肉质特征来评价生鲜肉及其肉制品品质,如瘦肉率、嫩度、pH 值、肉色等,但是由于饲养条件和猪个体存在差异,且测定过程中对供试样品的采集时间和取样部位有要求,所以测定结果不稳定不可靠。因此探索快捷、准确的分子标记技术进行陆川猪纯种的鉴伪,对陆川猪的发展有重要意义。
DNA分子标记(DNA molecular marker)是以生物大分子的多态性为基础的一种遗传标记,它是DNA水平遗传多样性的直接反映。DNA多态性在作物的遗传育种和品种鉴定中已经得到了广泛的应用。畜牧业方面,黄敏瑞
[1]、孙俊丽
[2]等利用DNA多态性分析了陆川猪与华南其他品种猪的遗传进化关系;还有利用DNA分子鉴定技术将牦牛与黄牛等加以区分的报道
[3]。ISSR(intersimple sequence repeat)标记是在SSR基础上发展起来的一类新型分子标记技术,以其较低的成本、简单的操作、良好的稳定性、重复性、多态性丰富以及能较好地反映物种的遗传结构和遗传多样性变化等特点,被视为理想的遗传标记方法,已经广泛应用在品种鉴定、物种的分类以及居群生物学的研究中
[4-5]。但是它在PCR扩增阶段需要一定时间来摸索最适反应条件,且是显性遗传标记,不能区分显性纯合基因型和杂合基因型。SSR和ISSR技术在食品溯源中主要应用在粮食作物、水果品种、蔬菜品种、动物产品的鉴别以及其他经济作物如橄榄树
[6]、条斑紫菜等的鉴别中。Nagaraju等
[7]用荧光ISSR和荧光SSR方法鉴定Basmati和非Basmati大米,在研究中分别用这两种方法绘制了指纹图谱,并进行了聚类分析,结果显示,这两种方法都显示了良好的分辨率、重复性和灵敏度,两种方法的结合可以很好的将一些品种区分开来。Montemurro等
[8]采用SSR和扩增片断长度多态性(amplified fragment length polymorphism,AFLP)法鉴定112 个油橄榄品种,从27 条SSR引物中得到多态性图谱引物对样品进行实验,并从AFLP引物序列中筛选出3对引物用于区分所有112 个样品。目前,用DNA分子鉴定技术来鉴别肉制品源性的研究并不多,特别是用于陆川猪及其产品的真伪鉴别的研究较少。鉴于目前的研究现状以及对陆川猪品牌产品的保护,本课题提取陆川猪及其杂交品种、巴马香猪和环江香猪及其肉制品的总DNA,用ISSR法分析DNA多态性,探索可用于鉴伪识别的陆川猪的检验方法,开发陆川猪及其肉制品的DNA分子鉴定技术。这对规范陆川猪市场和深加工企业的经营行为,引导深加工企业的健康发展以及维护“陆川猪”品牌形象具有重要意义。
1 材料与方法
1.1 材料与试剂
实验所采用的生鲜猪肉品种如表1所示,腊肉制品主要是采用表1中生鲜猪肉在实验室模拟加工而成。由于每头生鲜样品均取自原产地及纯种养殖场,所以可以保证样品的纯种性和真实性。
表1 供试的生鲜猪肉编号、品种、数量及来源
Table 1 Details of the pig breeds tested in this study
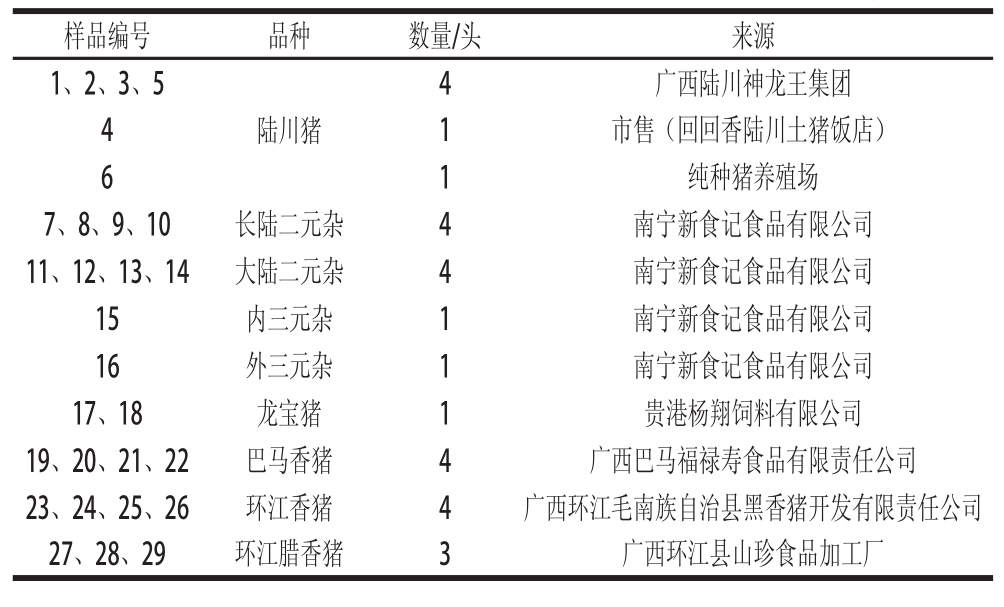
样品编号品种数量/头来源1、2、3、5陆川猪广西陆川神龙王集团4 1 4市售(回回香陆川土猪饭店)6 1纯种猪养殖场7、8、9、10长陆二元杂4南宁新食记食品有限公司11、12、13、14大陆二元杂4南宁新食记食品有限公司15内三元杂1南宁新食记食品有限公司16外三元杂1南宁新食记食品有限公司17、18龙宝猪1贵港杨翔饲料有限公司19、20、21、22巴马香猪4广西巴马福禄寿食品有限责任公司23、24、25、26环江香猪4广西环江毛南族自治县黑香猪开发有限责任公司27、28、29环江腊香猪3广西环江县山珍食品加工厂
实验设计了34 个ISSR引物(表2),其中引物1~5以及引物14~15,分别来自有关文献[9-11]中的7 个引物,其他ISSR引物都是自行设计的带有2~8 个重复碱基的序列,由英潍捷基(上海)贸易有限公司合成。
表2 引物序列
Table 2 Primer sequences

引物编号引物序列1 5’-CTCTCTCTCTCTCTCTTG-3’2 5’-CACACACACACAAC-3’3 5’-CTCTCTCTCTCTCTCTAC-3’4 5’-CTCTCTCTCTCTCTCTGC-3’5 5’-CACACACACACAGT-3’6 5’-GAGAGAGAGAGAGG-3’7 5’-GTGTGTGTGTGTGG-3’8 5’-GAGAGAGAGAGACC-3’9 5’-GTGTGTGTGTGTCC-3’105’-CACCACCACGC-3’115’-GAGGAGGAGGC-3’125’-CTCCTCCTCGC-3’135’-GTGGTGGTGGC-3’145’-CACACACACACAAG-3’155’-CACACACACACAGG-3’165’-CGCCGCCGCGC-3’175’-ATAATAATAGC-3’185’-ACAACAACAGC-3’195’-AGAAGAAGAGC-3’205’-GCGGCGGCGGC-3’215’-TATTATTATGC-3’225’-TCTTCTTCTGC-3’235’-TGTTGTTGTGC-3’245’-CTCCTCCTCAC-3’255’-CTCCTCCTCGT-3’265’-CTCCTCCTCTC-3’275’-CTCCTCCTCAT-3’285’-CTCCTCCTCCT-3’295’-CTCCTCCTCAG-3’305’-CTCCTCCTCCG-3’315’-CTCCTCCTCTG-3’325’-CTCCTCCTCGG-3’335’-CTCCTCCTCCC-3’345’-CTCCTCCTCTA-3’
1.2 仪器与设备
TGL-16G型高速台式离心机 上海医用分析仪器厂;DYY-5型稳压稳流电泳仪、DYY-6C型电泳仪 北京市六一仪器厂;BTS-20-M型紫外成像系统 英国Uvitec公司;UV-5200型紫外-可见分光光度计 上海元析仪器有限公司。
1.3 方法
1.3.1 样品DNA提取、纯化及纯度检验
称取生鲜猪肉0.2 g(腊肉0.5 g),采用改良后的十二烷基磺酸钠(sodium dodecylsulfate polyacrylamide,SDS)法提取样品DNA,原方法
[12-13]中使用了液氮研磨、蛋白酶K、酚-氯仿-异戊醇(25∶24∶1,V/V)、KAC等试剂,且需在50~55 ℃条件下温育数小时;改进后在冰上研磨样品,代替了液氮研磨,采用65 ℃温育,时间缩短到30 min,并分别使用饱和酚和氯仿-异戊醇(24∶1,V/V)进行2 次抽提。采用DNA纯化回收试剂盒(离心柱型),按照试剂盒使用说明书操作操作。用0.8%的琼脂糖凝胶电泳检测其完整性和纯度,用紫外分光光度计检测DNA的质量和浓度,分别测OD
260nm和OD
280nm[14-15]
。DNA纯度为OD
260nm/ OD
280nm。
1.3.2 PCR反应及产物检测
反应体系:模板DNA 1 μL、引物 2 μL、2×Taq PCR Master Mix 12.5 μL、ddH
2O补足至25 μL。
优化后的反应程序:95 ℃预变性5 min,然后95 ℃变性30 s,36 ℃退火30 s(退火温度进行梯度实验确定,不同的引物设置不同的温度),72 ℃延伸2 min,进行30个循环,最后72 ℃总延伸5 min。结束后降温到4 ℃。PCR反应产物用1.5%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 DNA提取结果与分析
采用改良后的SDS法提取样品的DNA,经过纯化回收后,通过凝胶电泳检测得到的条带比较清晰,片段大小一致,无降解现象,无明显的RNA条带干扰和污染。经过DNA纯度检测,所提DNA样品OD
260
nm/OD
280
nm比值均在1.7~2.0之间,表明DNA纯度能满足后续ISSR反应的需要。
由于腊肉制品特别是扣肉制品在制作过程中经过将近200 ℃的高温油炸,DNA破坏比较严重,这也给提取造成一定困难,但用此方法提取到的腊肉制品的DNA质量较好,与生鲜肉提到的DNA质量相差无几,且方法简单、操作方便、成本低廉,比文献[16]中提到的采用试剂盒、异硫氰酸胍法
[17]、酚-氯仿抽提法
[18]等方法更加实用和简单。
2.2 样品的ISSR检测结果与分析
2.2.1 纯种陆川猪及其杂交品种ISSR检测结果与分析
实验分别对生鲜猪肉和腊肉制品进行了P C R扩增和带型分析,在设计合成的34 个引物中,筛选出了1 个多态性好,条带清晰的引物(WM12:5’-CTCCTCCTCGC-3’)可用于区别陆川猪、二元杂猪和三元杂猪。如图1所示,引物WM12在陆川猪与二元杂猪、三元杂猪样品扩增获得900~1 000 bp特异带,其在二元杂猪、三元杂猪均有出现,而陆川猪没有此条带产生。同样的结果也出现在陆川猪与二元杂猪、三元杂猪的扣肉样品中,在大约900 bp处,5 头陆川猪均没有条带产生,而其他的长陆二元杂、大陆二元杂、外三元杂、龙宝猪和内三元杂均有一条比较清晰的条带产生。说明此引物能够将陆川猪与二元杂猪、三元杂猪的生鲜样品和腊肉样品区分。
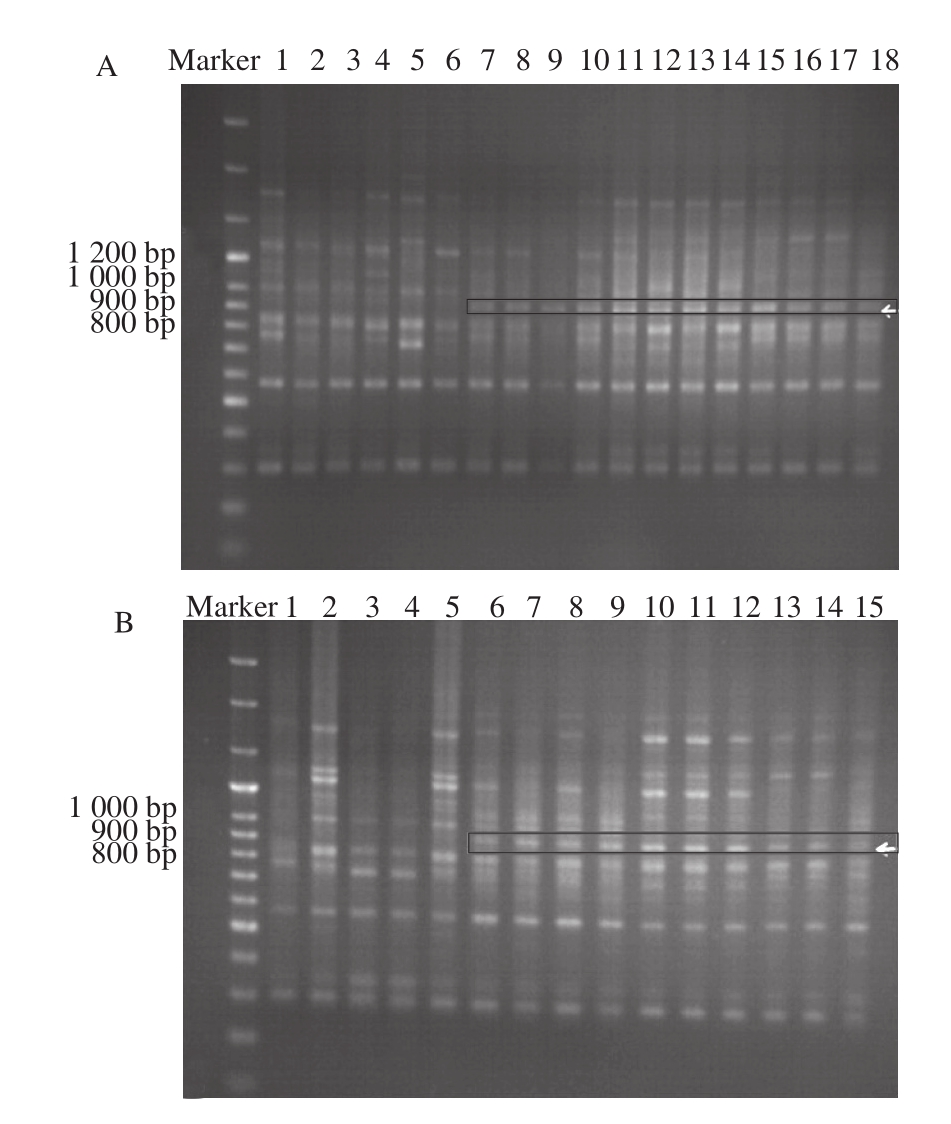
图1 引物12扩增出的生鲜肉(A)与腊肉(B)电泳图谱
Fig.1 Electrophoresis fingerprinting of amplification products from fresh meat (A) and Chinese bacon (B) using primer 12
引物12 PCR扩增时的退火温度为36 ℃,其中Marker 为100 bp Plus DNA Ladder,加入量为5 μL。图1A中1~6泳道为6头陆川猪PCR后的电泳图谱,7~10泳道为4 头长陆二元杂猪PCR后的电泳图谱,11~14泳道为4 头大陆二元杂猪PCR后的电泳图谱,15~18泳道分别为1头龙宝猪、2 头外三元杂猪和1头长陆长白内三元杂猪PCR后的电泳图谱;图1B中1~5泳道为5 头陆川猪腊肉样品PCR后的电泳图谱,6~9泳道为4 头长陆二元杂猪腊肉样品PCR后的电泳图谱,10~12泳道为3 头大陆二元杂猪腊肉样品PCR后的电泳图谱,13~15泳道分别为1头外三元杂猪、1 头龙宝猪和1头长陆长白内三元杂猪的腊肉样品PCR后的电泳图谱。样品加入量均为8 μL。
2.2.2 陆川猪和巴马香猪ISSR检测结果与分析
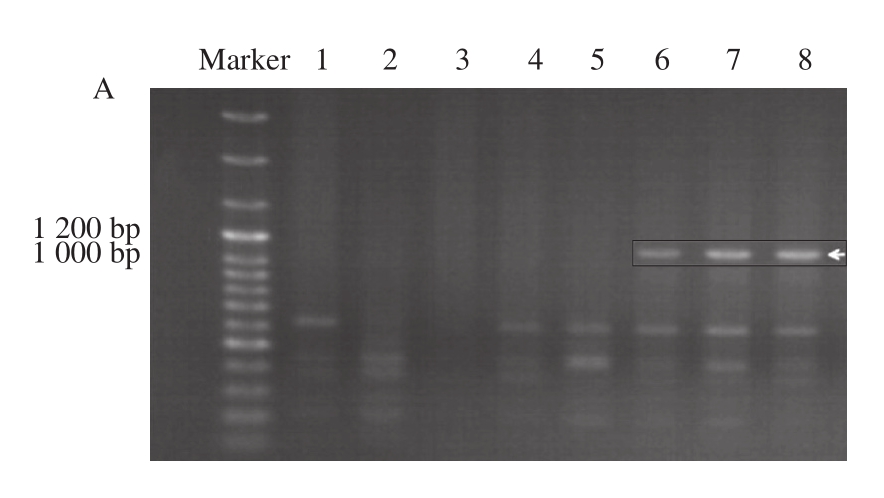
在34 个引物中,筛选出了1 个引物(WM27:5’-CTCCTCCTCAT-3’)用于区别陆川猪和巴马香猪。如图2所示,在1 000~1 200 bp之间,所有巴马香猪扣肉存在着一条明显的条带,而所有陆川猪都是没有这个条带。同样,陆川猪与巴马香猪扣肉样品的电泳图谱与生鲜陆川猪和巴马香猪的电泳图谱一致。说明此引物能够将陆川猪与巴马香猪的生鲜样品和腊肉样品区分。
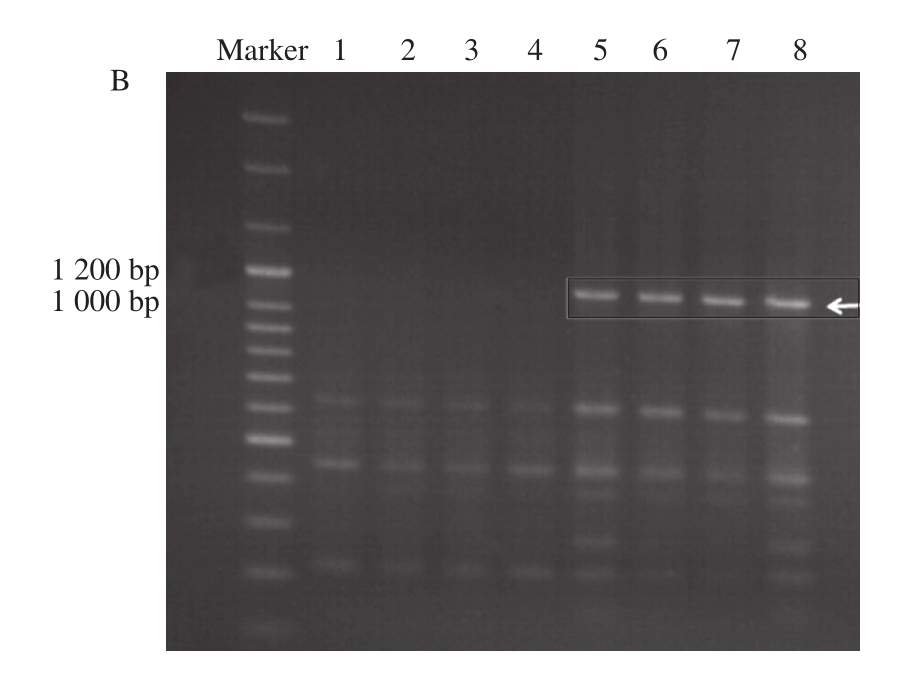
图2 引物27扩增出的生鲜肉(A)与扣肉(B)电泳图谱
Fig.2 Electrophoresis fingerprinting of amplification products from fresh meat(A) and braised meat (B) using primer 27
引物27 PCR扩增时的退火温度为36 ℃,其中Marker 为100 bp Plus DNA Ladder,加入量为5 μL。图2A中1~5泳道为5 头陆川猪样品PCR后的电泳图谱,6~8泳道为3 头巴马香猪样品PCR后的电泳图谱。图2B中1~4泳道为4 头陆川猪扣肉样品PCR后的电泳图谱,5~8泳道为4 头巴马香猪扣肉样品PCR后的电泳图谱。样品加入量均为8 μL。
2.2.3 陆川猪和环江香猪的ISSR检测结果与分析
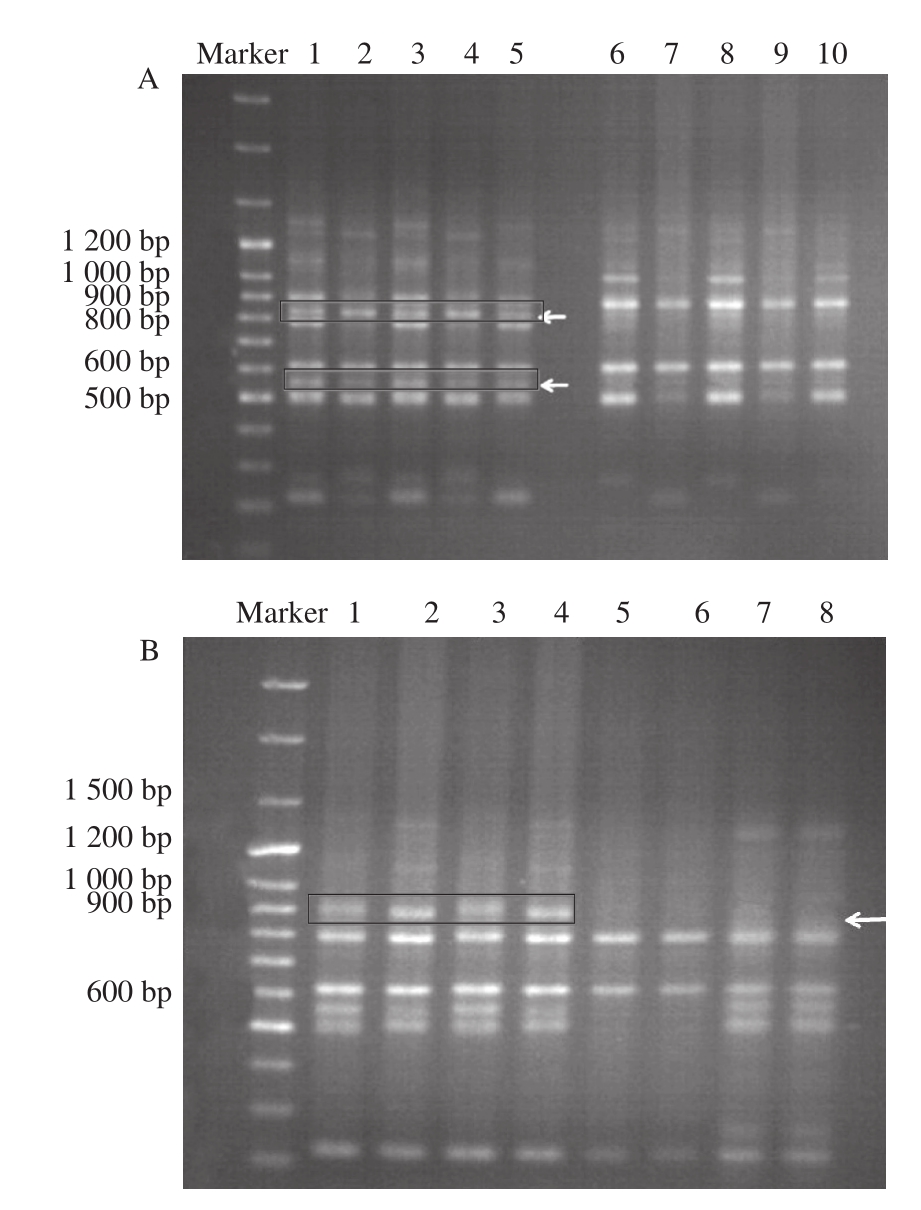
图3 引物10扩增出的生鲜肉(A)和腊肉(B)电泳图谱
Fig.3 Electrophoresis fingerprinting of amplification products from fresh meat (A) and Chinese bacon (B) using primer 10
引物10 PCR扩增时的退火温度为36 ℃,其中Marker 为100 bp Plus DNA Ladder,加入量为5 μL。图3A中1~5泳道为5 头陆川猪样品PCR后的电泳图谱,6~10泳道为5 头环江香猪样品PCR后的电泳图谱。图3B中1~4泳道为4 头陆川猪腊肉样品PCR后的电泳图谱,5~8泳道为4头环江腊香猪样品PCR后的电泳图谱。样品加入量均为8 μL。
在34 个引物中,筛选出了1 个引物(WM10:5’-CACCACCACGC-3’)用于区别陆川猪和环江香猪。如图3所示,引物WM10在陆川猪与环江香猪生鲜肉样品扩增获得800~900 bp之间和500~600 bp之间2 条特异带,陆川猪生鲜样品均有这两条特异带,而在环江香猪生鲜肉样品中均没有这两条特异条带。而在陆川猪与环江香猪腊肉制品电泳图谱中,在900 bp有特异带,在陆川猪腊肉样品中均有出现,但是在环江香猪腊肉样品中没有出现。说明引物能够将陆川猪和环江香猪的生鲜样品和腊肉样品区分。
3 讨 论
陆川猪的养殖已从过去的农户散养发展成现在规模化的养殖,肉制品加工产业也得到了迅速的发展。但是,市场上利用杂交猪冒充陆川猪的现象却层出不穷。传统的胴体品质和肉质品质评价可以大致体现陆川猪与其他品种猪的差别
[19],但却没有严格的界限,难以作为区别陆川猪及其他品种猪的标准。胴体品质包括宰前活质量、胴体质量、胴体长、屠宰率、瘦肉率、眼肌面积、膘厚、皮厚、骨质量等指标;肉质指标包括肉色、系水力、嫩度、pH值、大理石纹、肌肉脂肪、肌纤维直径、游离氨基酸含量等指标。一般的质检人员在实际操作中很难根据这些指标鉴别陆川猪肉的真伪。首先,供试样品不易获得,测定胴体指标需要对整头猪胴体进行评价;测定肉质指标时,对猪的年龄、性别、样品部位、宰后时间有严格的要求,这对于实验操作特别是市场采样是不现实的。再者,这些指标均受饲养条件和个体差异的影响,往往是不稳定的,没有统一的鉴别标准。另外,对加工变形后腊肉制品更是无法检测。
而分子标记技术直接以DNA的形式表现,具有很高的稳定性,在生物体的各个组织及各个发育阶段均稳定存在,不受取样部位、年龄、生长条件等的限制。分子标记技术操作简便,价格低廉,准确度高,结果稳定可靠,易于实现标准化,检测时间短,检测样品多,一次可对100多份样品同时进行检测,具有高效、快捷、实用性强的优点
[20]。随着科技的进步,分子标记技术也在不断的发展和完善。ISSR 技术的应用在动物遗传结构研究的相关领域也逐渐被采纳
[21]。本实验利用ISSR技术探索一种可以快速准确的对陆川猪及其肉制品进行真伪鉴定的方法。
ISSR技术中,引物的设计具有随机性和其扩增结果具有不可预见性。一般要设计大量候选引物,而最终有效的引物却为数极少。本研究设计了34 条,从中获得3 条有效引物。其中,引物WM12(5’-CTCCTCCTCGC-3’)能够区分陆川猪与其二元杂猪、三元杂猪;引物WM27(5’-CTCCTCCTCAT-3’)可以区分陆川猪和巴马香猪的生鲜样品及腊肉制品;引物WM10(5’-CACCACCACGC-3’)可用于区分陆川猪与环江香猪。韩晓磊等
[22]从77 个ISSR引物中选出3 条引物对同为雅罗鱼亚科鱼类的鲶鱼、草鱼及赤眼鳟的DNA进行扩增,得出ISSR技术可以对形态特征差异不明显的鲶鱼、草鱼和赤眼鳟进行分子水平的区分鉴定,与本实验的研究有相同之处。笔者也注意到,同是陆川猪样品,其扩增得到的带型并不完全一致,这也体现了陆川猪这一品种内具有一定的遗传多样性,虽然如此,但是从陆川猪与其他品种的猪肉制品的各个电泳图谱中可以清晰的看到其他猪肉制品具有特异带,陆川猪是没有的,可以依据这些特异性条带对陆川猪进行鉴定。
4 结 论
综上所述,利用ISSR技术可快速准确的鉴定陆川猪、陆川猪杂交品种、巴马香猪、环江香猪及其肉制品。研究结果对规范陆川猪市场和深加工企业的经营行为,引导深加工企业的健康发展以及维护“陆川猪”品牌形象具有重要的意义,同时也为广西地方猪的育种和标准化养殖提供参考,也希望能为其他肉类产品的鉴伪识别提供可借鉴的技术方法。
参考文献:
[1] 黄敏瑞, 孙俊丽, 潘天彪, 等. 6个微卫星DNA标记在陆川猪群体中的遗传多样性分析[J]. 广西畜牧兽医, 2008, 24(2): 67-69.
[2] 孙俊丽, 张冰, 马青艳, 等. 陆川猪mtDNA D-loop 序列遗传多样性分析[J]. 中国畜牧兽医, 2010, 37(6): 122-125.
[3] 古玉军. 中国部分黄牛mtDNA CytB 基因部分序列遗传多样性研究[D].成都: 四川农业大学, 2006.
[4] BORNET B, BRANCHARD M. Nonanchored inter simple sequence repeat (ISSR) markers: reproducible and specific tools for genome fingerprinting[J]. Plant Molecular Biology Reporter, 2001, 19: 209-215.
[5] 赵丽娟, 张宗文, 黎裕, 等. 苦荞种质资源遗传多样性的ISSR分析[J].植物遗传资源学报, 2006, 7(2): 159-164.
[6] BRETON C, CLAUX D, METTON I, et al. Comparative study of methods for DNA preparation from olive oil samples to identify cultivar SSR alleles in commercial oil samples: possible forensic applications[J]. Journal of Agricultural and Food Chemistry, 2004, 52 (3): 531-537.
[7] NAGARAJU J, KATHIRVELI M, RAMESH K R, et al. Genetic analysis of traditional and evolved Basmati and non-Basmati rice varieties by using fluorescence-based ISSR-PCR and SSR markers[J]. PNAS, 2002, 99: 5839-5841.
[8] MONTEMURRO C, SIMEONE R, PASQUALONE A, et al. Genetic relationships and cultivar identification among 112 olive accessions using AFLP and SSR markers[J]. Journal of Horticultural Science & Biotechnology, 2005, 80: 105-110.
[9] WOLFE A D, XIANG Q Y, KEPHART S R, et al. Assessing hybridization in natural populations of Penstemon (Scrophulariacese) using hypervariable inter-simple sequence repeat (ISSR) bands[J]. Molecular Ecology, 1998, 7(9): 1107-1125.
[10] WOLFE A D, XIANG Q Y, KEPHART S R, et al. Diploidhybird speciation in Penstemon (Scrophulariacese) [J]. Proceeding of the National Academy of Sciences, 1998, 95: 5112-5115.
[11] WOLFE A D, XIANG Q Y, KEPHART S R, et al. Old wine in new skin: reassessing hybridization in Penstemon using microsatellitebased markers[J]. American Journal of Botany, 1998, 84(6): 245-246.
[12] 赵瑞杰, 严海燕, 谭艳平, 等. CTAB法提取动DNA[J]. 中国西部科技, 2011, 21(10): 7-8.
[13] 何建文, 韩建林, 罗玉柱. 利用不同方法从深加工牦牛肉产品中提取基因组DNA效果的比较[J]. 生物技术通报, 2010(10): 162-167.
[14] 张维铭. 现代分子生物学实验手册[M]. 北京: 科学出版社, 2003: 83-89.
[15] 高丹丹, 陈燕, 王迎华, 等. 动物肉制品基因组DNA的提取和纯化[J].食品科技, 2007(8): 42-44.
[16] 何建文, 韩建林, 罗玉柱. 利用不同方法从深加工牦牛肉产品中提取基因组DNA效果的比较[J]. 生物技术通报, 2010(10): 162-167.
[17] 邵碧英, 陈文炳, 郑腾, 等. 动物产品中牛、羊源性成分多重PCR检测方法的建立[J]. 畜牧与兽医, 2004, 36(3): 7-9.
[18] SAMNROOK J, RUSSELL D. 分子克隆实验指南[M]. 3版. 北京: 科学出版社, 2002: 463-471.
[19] 何若钢, 张文明, 覃小荣, 等. 陆川杂优猪与另外几种品种猪胴体品质和肉质比较[J]. 上海畜牧兽医通讯, 2008(2): 25-27.
[20] 王建华, 戈新, 李培培, 等. 猪肉品质评定与营养调控措施[J]. 饲料研究, 2009(12): 23-26.
[21] 林杰君, 鲍毅新, 刘军, 等. ISSR分子标记及其在动物遗传结构研究中的应用[J]. 生态学杂志, 2012, 31(5): 1319-1326.
[22] 韩晓磊, 郁建峰, 陆秀乡, 等. 雅罗鱼亚科鱼类(鳡鱼、草鱼及赤眼鳟)的ISSR分子鉴定[J]. 水产科学, 2010, 29(9): 546-549.
Species Authentication of Luchuan Pig Meat and Meat Products Using ISSR Molecular Markers
HE Yu-ling
1, HUANG Li
1,*, FENG Yi
2,*, WANG Miao
1, TENG Jian-wen
1
(1. Institute of Light and Food Engineering, Guangxi University, Nanning 530004, China;
2. Faculty of Preclinical Medicine, Guangxi University of Chinese Medicine, Nanning 530001, China)
Abstract:In this study, species identification of Luchuan pig meat and meat products was carried out by DNA fingerprint profiling of meats from purebred Luchuan, hybrid Luchuan, Bama miniature and Huangjiang miniature pigs using ISSR (inter-simple sequence repeat) molecular markers. The results showed that 3 clear and repeatable primer pairs WM12, WM27 and WM10 were selected from 34 primers. WM12 was useful for discriminating fresh and cured meat from purebred Luchuan and hybrid Luchuan pigs, while Luchuan pigs could be distinguished from Bama miniature pigs by using WM27, and from Huangjiang miniature pigs by using WM10. In conclusion, the ISSR method enables rapid and accurate identification of fresh meat and meat products from purebred Luchuan, hybrid Luchuan, Bama miniature and Huangjiang miniature pigs.
Key words:Luchuan pigs; molecular marker technology; inter-simple sequence repeat (ISSR)
中图分类号:TS251.5
文献标志码:A
文章编号:1001-8123(2014)10-0010-05
收稿日期:2014-08-03
基金项目:广西科技攻关计划项目(桂科攻12118011-2A)
作者简介:何瑜林(1990—),女,硕士研究生,研究方向为农产品加工与贮藏。E-mail:1158330580@qq.com
*通信作者:黄丽(1979—),女,副教授,博士,研究方向为农产品加工与贮藏。E-mail:mary607@126.com
封毅(1967—),男,高级工程师,博士,研究方向为微生物与生物化学。E-mail:1277970221@qq.com