
王月宏,莎丽娜*
(内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
摘 要:以羊肌腱为实验材料,经脱脂、脱钙、除杂蛋白后,用盐酸胍去除蛋白多糖,经胃蛋白酶酶解、氯化钠盐析、透析后对其进行提取工艺的研究与鉴定。结果表明,单因素试验及正交试验确定最佳工艺条件为酶解时间60 h、酶添加量4%、0.1 mol/L柠檬酸溶液添加量5 mL/g进行羊肌腱提取。紫外光谱分析结果显示:所提胶原最大吸收峰220 nm,证明提取物为胶原蛋白。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳结果表明:羊肌腱中存在的蛋白主要是Ⅰ型胶原蛋白。经红外光谱分析,进一步证明提取的胶原蛋白为Ⅰ型胶原蛋白且结构完整。
关键词:Ⅰ型胶原蛋白;提取工艺;鉴定
胶原(collagen)是由动物细胞合成的一种生物高分子,具有保护机体功能的作用。动物的键、角、韧带、骨、血管等,主要成分都是胶原,在生物体内起着重要的作用。胶原蛋白资源丰富并含有丰富的氨基酸,口感柔和、易于消化,被用在许多保健性食品和营养性食品中 [1-2]。胶原经过适当处理具有良好的生物降解性、生物可吸收性和生物相容性 [3],因此,可成为一种理想的生物新材料以期应用于组织的修复和器官重建研究中。Ⅰ型胶原蛋白呈组织特异性分布,存在于多种结缔组织中,属于成纤维胶原 [4]。目前,至少有19 种不同类型的胶原被发现通过单克隆抗体及基因工程技术已发现了,最常见的是Ⅰ、Ⅱ、Ⅲ型胶原,其中Ⅰ型胶原占总胶原80%以上,含量最高 [5]。目前,关于胶原蛋白提取工艺的研究报道很多 [6-7],为了提高原料利用,本实验以羊肌腱为原料进行胶原蛋白的提取,并研究不同酶质量分数、酶解时间以及柠檬酸添加量对羊肌腱中胶原蛋白得率的影响,为羊肌腱高效利用提供一定的理论依据。
1.1 材料与试剂
羊肌腱 市售。
胃蛋白酶(1∶10 000)、标准Ⅰ型胶原蛋白 美国Sigma公司;盐酸胍 美国Amresco公司;MD34透析袋(8 000~14 000 ku) 北京Solarbio公司;氯仿、甲醇、柠檬酸、乙酸、氯化钠均为分析纯。
1.2 仪器与设备
LGJ-25C压盖型冷冻干燥机 北京四环科学仪器厂有限公司;IRAffinity-1型红外光谱仪 日本岛津公司;BG-Power600电泳仪 北京百晶生物技术有限公司;H2500R-2高速冷冻离心机 长沙湘仪离心机仪器有限公司;TU-1810紫外可见分光光度计 北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 羊肌腱预处理
将羊肌腱从羊蹄中取出,去除肌腱膜,在―20 ℃冰箱冷冻过夜硬化后取出,再用手术刀仔细刮去肌腱表面的残余筋膜,用生理盐水冲洗几遍后放入―20 ℃冰箱内备用。
1.3.2 羊肌腱脱脂及除多糖
参照焦坤等 [8]和李振飞等 [9]的方法略做改动。将预处理好的羊肌腱从冰箱中取出,用手术刀切成2~3 mm的碎片,然后称质量。用质量分数10%的NaCl溶液在常温下搅拌48 h,用蒸馏水充分洗涤后,按照1∶20(g/mL)的比例在羊肌腱中添加脱脂液(氯仿∶甲醇∶水=1∶2∶0.8(V/V)),在4℃搅拌48 h,用蒸馏水洗3~5遍。冲洗干净后按照1∶10(g/mL)的比例在羊肌腱中添加4 mol/L的盐酸胍溶液,在4℃搅拌48 h后,12 000h g离心30 min,沉淀用0.1 mol/L柠檬酸充分洗涤3~5遍,得到脱脂及除多糖后羊肌腱,以此为试材进行以下实验。但添加胃蛋白酶及柠檬酸仍以未脱脂除糖羊肌腱计。
1.3.3 提取工艺单因素及正交试验
在每克羊肌腱中分别加入一定量的胃蛋白酶和柠檬酸溶液,并酶解一定时间,采用单因素试验结合正交试验确定酶添加量、柠檬酸添加量、酶解时间对Ⅰ型胶原蛋白得率的影响。具体单因素试验水平如下:胃蛋白酶添加量为2%、4%、6%、8%,0.1 mol/L的柠檬酸添加量为5、10、15、20 mL/g,酶解时间分别为36、48、60、72 h。在单因素试验基础上进行正交试验,确定最佳提取条件。每组试验重复5次取平均值。

1.3.4 Ⅰ型胶原蛋白的鉴定
1.3.4.1 紫外吸收光谱的鉴定
将提取的羊肌腱胶原蛋白溶于0.5 mol/L乙酸溶液中,乙酸溶解液作为空白对照,进行紫外吸收光谱的测定在190~390 nm的波长范围内 [10]。
1.3.4.2 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
浓缩胶3.5%(pH 6.8),分离胶7.5%(pH 8.8),电泳电压100 V,直到分离胶下边缘1 cm时停止电泳。采用考马斯亮蓝R-250染色,用蒸馏水漂洗1次,然后用脱色液脱色直到蛋白条带清晰为止 [11]。
1.3.4.3 傅里叶变换红外图谱
25 ℃条件下研钵中放入少量胶原蛋白样品,再加入适量KBr利用压片机压成薄片。红外光谱对胶原蛋白KBr压片进行扫描,扫描范围500~4 000 cm -1。
2.1 提取工艺单因素试验
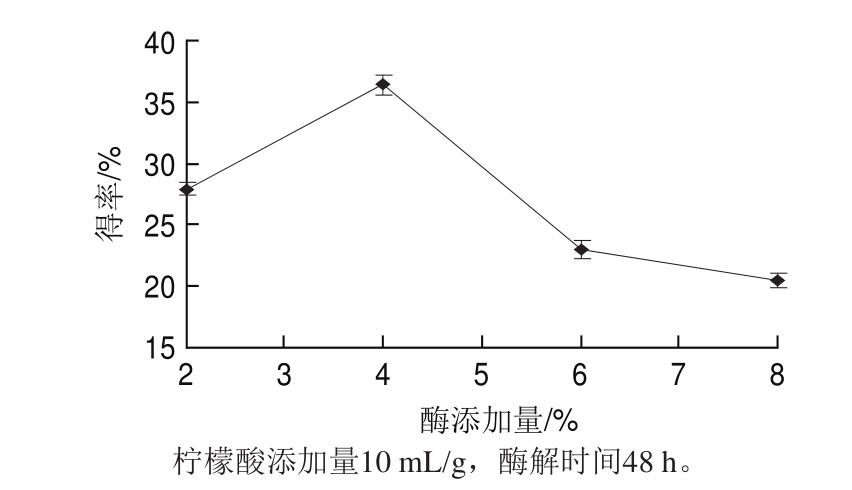
图1 酶添加量对得率的影响
Fig.1 Effect of enzyme concentration on the yield of type I collagen
2.1.1 酶添加量对胶原蛋白得率的影响由图1可知,羊肌腱Ⅰ型胶原蛋白得率随着酶添加量增加,先增大后减小,在4%时得率达到最大,为36.4%。当酶的用量增加时促进了胶原蛋白水解,得率下降。
2.1.2 柠檬酸添加量对胶原蛋白得率的影响
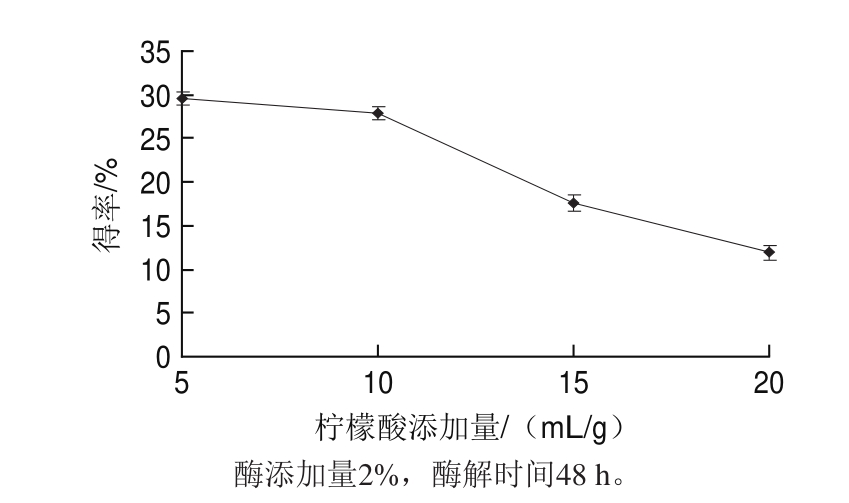
图2 柠檬酸添加量对得率的影响
Fig.2 Effect of solvent to substrate ratio on the yield of type I collagen
由图2可知,羊肌腱Ⅰ型胶原蛋白得率随着柠檬酸用量的增加而减小,柠檬酸添加量为5 mL/g时得率最大,为29.6%,当添加柠檬酸的量继续增大时,首先导致酶与底物浓度变小,反应不彻底;其次会使胶原蛋白水解,故柠檬酸添加量继续增大,得率反而下降。但添加量小于5 mL/g时,无法使羊肌腱溶解,所以本实验从柠檬酸添加量5 mL/g开始研究其对得率的影响。
2.1.3 酶解时间对胶原蛋白得率的影响
由图3可知,羊肌腱Ⅰ型胶原蛋白得率随着时间的增加而增大。在48 h之前增加的速率最大,48 h之后变慢。因为在48 h基本反应完全,48 h后底物与酶的浓度很低,导致胶原蛋白得率涨幅很小。
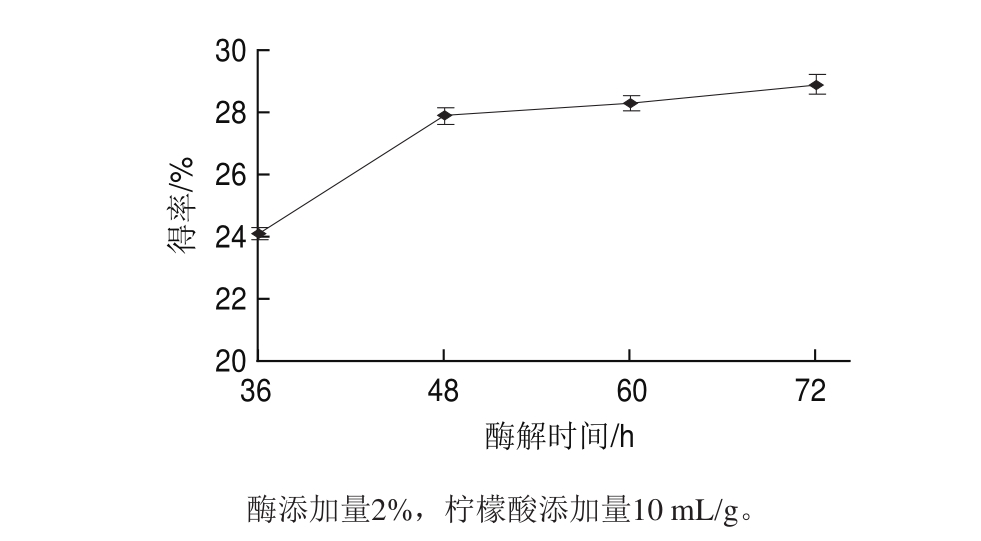
图3 酶解时间对得率的影响
Fig.3 Effect of hydrolysis time on the yield of type I collagen
2.2 提取工艺正交试验
表1 正交试验设计及结果
Table 1 Orthogonal array design and resulds
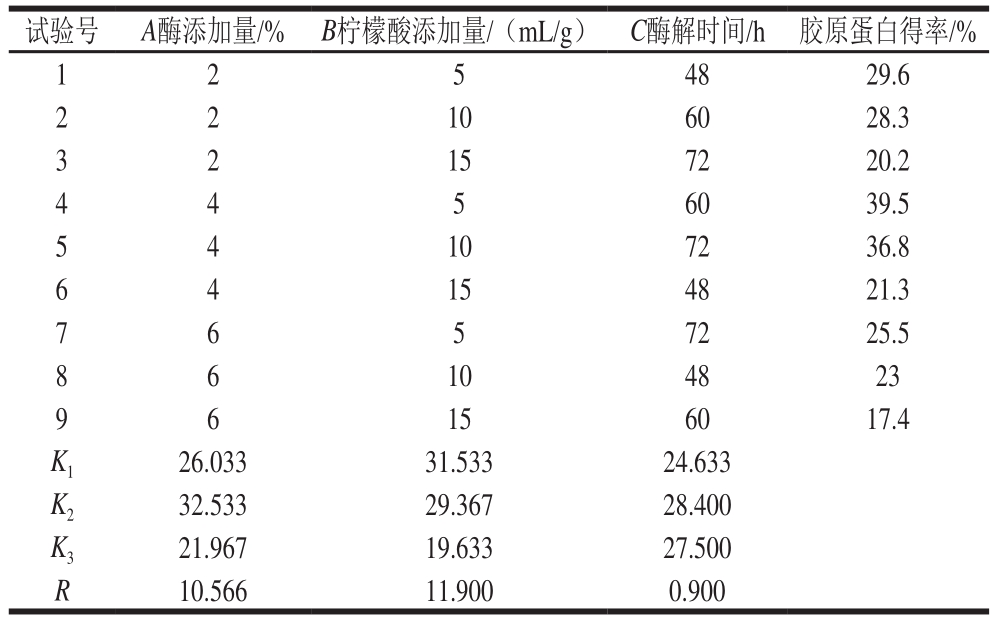
试验号A酶添加量/%B柠檬酸添加量/(mL/g)C酶解时间/h胶原蛋白得率/% 1 2 5 4829.6 2 1060 28.3 3 2 157220.2 2 4 6039.5 5 4 107236.8 4 5 6 154821.3 7 6 5 7225.5 4 8 104823 9 6 156017.4 6 K 126.03331.53324.633 K 232.53329.36728.400 K 321.96719.63327.500 R10.56611.9000.900
由表1可知,各因素主次顺序为B>A>C,即各因素对胶原蛋白得率影响最大为柠檬酸添加量,其次是酶添加量,最后是酶解时间,故最优组合为A 2B 1C 2,即添加酶添加量4%、柠檬酸添加量5 mL/g、酶解时间60 h,在此优化水平下进行验证实验,胶原蛋白得率为39.5%。
2.3 羊肌腱胶原蛋白鉴定
2.3.1 紫外可见光光谱分析
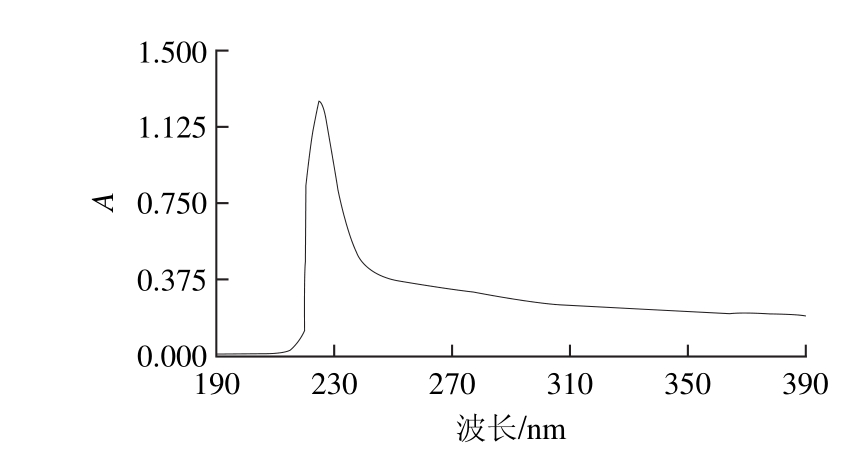
图4 羊肌腱I型胶原蛋白的紫外吸收光谱
Fig.4 Ultraviolet absorption spectrum of type I collagen from sheep tendon
由图4可知,由于胶原蛋白只含有较少的色氨酸和酪氨酸,在280 nm处无明显的吸收峰,在220 nm处有最大吸收峰且无杂峰,符合胶原蛋白的特性。因此,通过紫外图谱可以初步判定有较高纯度的胶原蛋白存在 [12]。
2.3.2 电泳分析
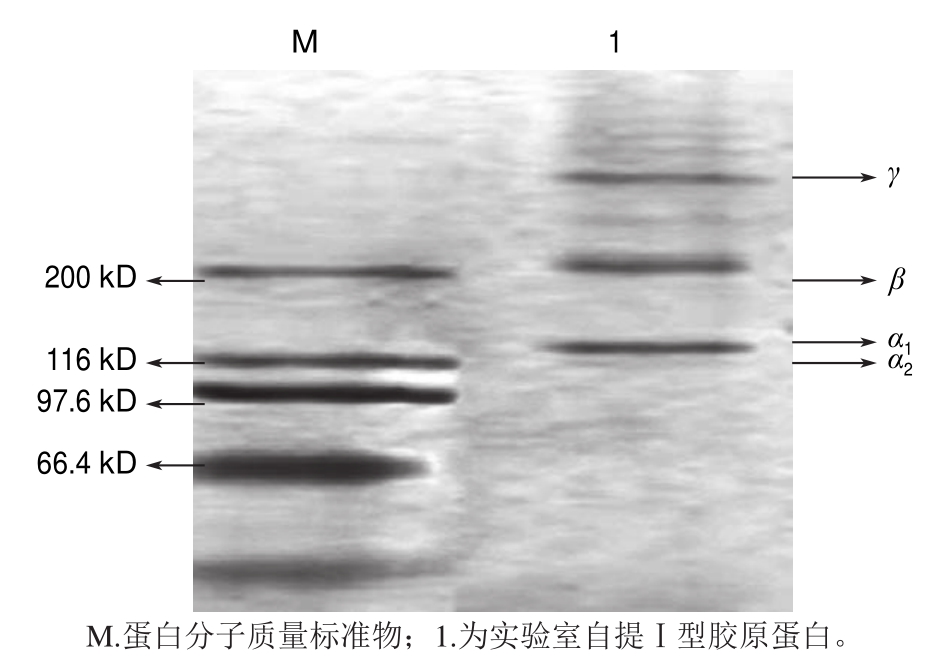
图5 羊肌腱I型胶原蛋白电泳图
Fig.5 Electrophoretogram of type I collagen from sheep tendon
由图5可知,实验室自提胶原蛋白符合Ⅰ型胶原蛋白的特征,具有明显的α、β、γ结构。高于200 kD带是Ⅰ型胶原的γ链,为α链三聚体;在200 kD附近的带是Ⅰ型胶原的β链,为α链二聚体,在116 kD附近出现了Ⅰ型胶原的α 1和α 2链。提取的Ⅰ型胶原蛋白没有多余条带,说明提取的胶原蛋白保证了完整结构,并未水解成小分子片段 [13],可以确定提取物为Ⅰ型胶原蛋白。
2.3.3 红外光谱分析
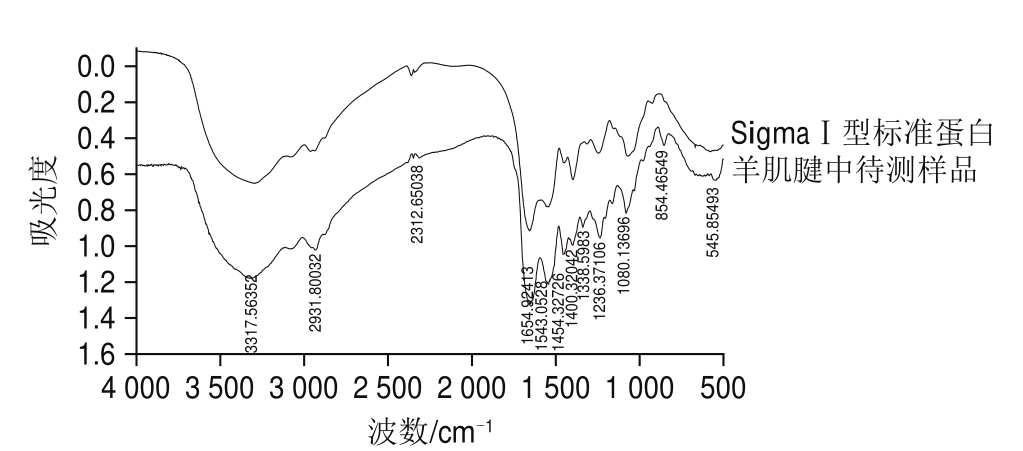
图6 SigmaI型胶原蛋白与羊肌腱提取的I型胶原蛋白红外图谱
Fig.6 Infrared spectra of type I collagen standard (Sigma) and type I collagen from sheep tendon
由图6可知,所提胶原蛋白与Ⅰ型胶原蛋白红外图谱基本一致。图中3 317 cm -1是酰胺A带Nü H伸缩振动(氢键)峰,表明存在三股螺旋结构。在1 664 cm -1出现的强峰是酰胺Ⅰ带的C=O伸缩振动,也是α螺旋的COO -反对称收缩振动峰,在1 543 cm -1出现的峰是酰胺Ⅱ带的Nü H弯曲振动,在1 454~1 236 cm -1出现的吸收峰表明胶原蛋白三股螺旋结构完整 [14-15],在1 080 cm -1附近为酰胺Ⅳ带的Nü H伸缩振动或是Cü N伸缩振动。红外特征图谱进一步表明,本实验所提取的羊肌腱胶原蛋白为Ⅰ型胶原蛋白,且结构完整。
羊肌腱中含有大量Ⅰ型胶原蛋白,是提取Ⅰ型胶原蛋白的理想材料。现有研究大多采用猪皮和鱼皮为原料 [16-17]。由于内蒙古羊肉资源丰富,羊肌腱获取容易且价格低廉,鉴于以上情况,实验选用酸溶液-胃蛋白酶体系,在酸性条件下用胃蛋白酶处理,不仅保持了胶原的三股螺旋结构完整性,而且可切断胶原分子N及C端的非胶原性肽 [18-20],从而使更多不溶性胶原蛋白成为可溶性并保持胶原分子的完整性。这种做法克服了单一提取的缺陷,同时增加了提取效率。李卫林等 [21]指出胶原多肽的融化温度在20~45 ℃的范围内。本实验改进了刁雪洋 [22]猪皮胶原蛋白提取方法,更严格的控制了提取条件,防止胶原分子在提取中变性。因此本实验均在4 ℃进行。
单因素结合正交试验优化结果可知,最优提取条件为胃蛋白酶添加量2%、柠檬酸添加量5 mL/g、酶解时间60 h,在此条件下从羊肌腱中提取的胶原蛋白得率为39.5%。
羊肌腱中提取物通过紫外光谱分析结果显示按上述条件所提物质为胶原蛋白。傅里叶红外光谱和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳进一步表明胶原蛋白为Ⅰ型胶原蛋白,结构完整且纯度较高,为动物性胶原蛋白提取提供理论依据。
参考文献:
[1] WHOUGHBY C E, BATTERBURY M KAYE S B. Collagen corneal shields[J]. Survey of Ophthalmology, 2002, 47(2): 174-182.
[2] 陈秀金, 曹健, 汤克勇. 胶原蛋白和明胶在食品中的应用[J]. 郑州工程学院学报, 2002, 23(1): 66-69.
[3] 张其清, 王彭延, 朱明华, 等. 胶原材料的生物学评价[J]. 生物医学工程学杂志, 1989, 6(3): 216-218.
[4] PROCKOP D J, KIVIRIKKO K I. Collagens: molecular biology, diseases, and potentials for therapy[J]. Annual Review Biochemisty, 1995, 64: 403-34.
[5] 李梅.Ⅰ型胶原蛋白与骨质疏松症研究进展[J]. 国外医学: 内分泌学分册, 2000, 20(1): 14-17.
[6] 王信苏, 汪之和. 草鱼鱼鳞胶原蛋白的提取[J]. 现代食品科技, 2006, 22(4): 148-150.
[7] 王建辉, 李琦, 刘在群, 等. 鹿皮胶原的提取与性质[J]. 吉林大学自然科学学报, 2001(1): 106-108.
[8] 焦坤, 莎丽娜. 羊肩胛软骨中Ⅱ型胶原蛋白的提取、鉴定及溶解度分析[J]. 肉类工业, 2012(5): 23-26.
[9] 李振飞, 莎丽娜. 羊软骨中Ⅱ型胶原蛋白的提取纯化与鉴定[J]. 食品科技, 2013, 38(3): 233-236.
[10] 曹慧, 许时婴. 鸡胸软骨II型胶原的制备及功能性研究[D]. 无锡: 江南大学, 2008.
[11] HAO Shuxian, LI Laihao, YANG Xianqing, et al. The characteristics of gelatin extracted from Sturgeon (Acipenser baeri) skin using various pretreatments[J]. Food Chemistry, 2009, 115(1):124-128.
[12] 徐新宇. 胶原的提取、改性、交联及其应用[J]. 透析与人工器官, 2004, 15(3): 38-46.
[13] 王川, 李燕, 马志英. 几种酶法从猪皮中提取胶原蛋白的对比研究[J].食品科学, 2007, 28(1): 201-204.
[14] PLEPIS A M G, DAS-GUPTA D K, GOISSIS G. Pyroelectric properties of anionic collagen and anionic collagen: P (VDE/TRFE) composites[C]//Proceedings of the 10th International Symposium on Electrets, Athens, Greece, 1999: 233-236.
[15] HE Li, HUA Linchen, RONG Luo, et al. The interaction between collagen and an aluminum tanning agent[J]. Macromolecular Bioscience, 2003, 3(7):344-346.
[16] 曾名勇, 张联英, 刘尊英, 等. 几种鱼皮胶原蛋白的理化特性及其影响因素[J]. 中国海洋大学学报, 2005, 35(4): 608-612.
[17] 薛新顺, 罗发兴, 罗志刚, 等. 猪皮胶原蛋白的提取及粘度特性研究[J].中国胶黏剂, 2007, 16(3): 15-18.
[18] 蒋挺大. 胶原蛋白[M]. 北京: 化学工业出版社, 2001.
[l9] 永井裕, 藤本大三郎. 胶原蛋白实验方法[M]. 刘平, 译. 上海: 上海中医学院出版社, 1992.
[20] 秦玉青. 鱿鱼皮胶原蛋白的提取和利用研究[D]. 上海: 上海水产大学, 2002.
[21] 李卫林, 曹健, 汤克勇, 等. 胶原蛋白结构和稳定性关系研究[J]. 中国皮革, 2005, 34(23): 14-16.
[22] 刁雪洋. 猪皮胶原蛋白提取及理化特性的研究[D]. 重庆: 西南大学, 2010.
Extraction of Type Ⅰ Collagen from Sheep Tendon
WANG Yue-hong, SHA Li-na*
(College of Food Science and Engineering, Inner Mongolia Agricultural University, Hohhot 010018, China)
Abstract:Type Ⅰ collagen from sheep tendon was prepared by the following sequential steps: degreasing and decalcification of the starting raw material, removal of impurity proteins, removal of proteoglycans by extraction with guanidinium hydrochloride, pepsin-catalyzed hydrolysis, salting out with sodium chloride and dialysis. The optimal conditions for enzymatic hydrolysis were determined by single-factor experiments and orthogonal array design experiment as hydrolysis at an enzyme concentration of 4% for 60 h in 0.1 mol/L citric acid with a solvent to substrate ratio of 5:1 mL/g. UV spectral analysis of the resultant extract showed maximum absorption at approximately 220 nm, confirming it to be collagen. The protein composition of sheep tendon was dominated by type I collagen, as demonstrated by SDS-PAGE analysis. The extract was further confirmed by infrared spectral analysis to be type Ⅰ collagen with intact structure.
Key words:type Ⅰ collagen; extraction process; identification
中图分类号:TS251
文献标志码:A
文章编号:1001-8123(2014)01-0008-04
收稿日期:2013-12-10
基金项目:内蒙古自治区自然科学基金项目(2011MS1208)
作者简介:王月宏(1986ü),男,硕士,研究方向为肉品生物技术与加工工程。E-mail:674264303@163.com
*通信作者:莎丽娜(1966ü),女,副教授,博士,研究方向为肉品微生物。E-mail:huercha0505@163.com